Etusivu » tutkimukset
Category Archives: tutkimukset
Testaa muuntosi, ellet voi hyvin tyroksiinilla!
Tiedätkö, että voit testata muuntosi, mikäli sinulla on samaan aikaan otetut TSH, T4-V ja T3-V, sekä niiden viiterajat?
Lääketieteellisen perustan testille löydät täältä: https://www.frontiersin.org/articles/10.3389/fendo.2016.00057/full
https://www.frontiersin.org/article/10.3389/fendo.2016.00057
Käy lataamassa koneellesi Spina-Thyr-ohjelma. http://spina.sourceforge.net/download.html
Käyttöohje englanniksi: https://sourceforge.net/projects/spina/files/Documentation/
Kun olet ladannut ohjelman ja asentanut sen koneellesi, eteesi aukeaa pääikkuna. Valitse ylävasemmalta Edit ja sieltä Preferences, niin pääset asettamaan mittayksiköt ja viitealueet.

Kun rastitat Remember-ruudun, ohjelma muistaa yksiköt. FT4 = T4-V ja FT3 = T3-V. Älä koske muihin arvoihin. Voit tallentaa laboratorioviitteet haluamaasi paikkaan napilla Save to file. Painettuasi OK pääset takaisin alkunäyttöön.
Syötä sinne mittaustulokset.
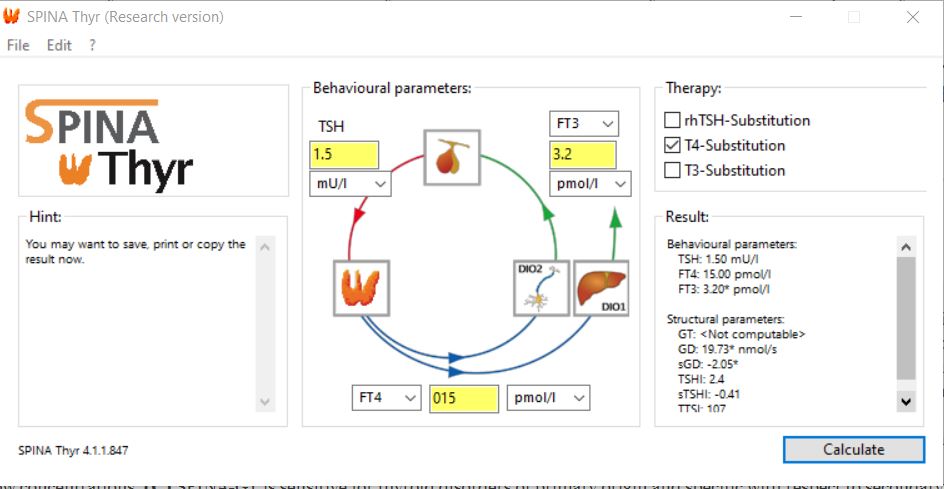
Merkitse lääkityksesi. Jos käytät tyroksiinia, rastita T4-substitution. Muuntoa ei voi laskea, jos käytät T3-lääkettä.
Klikkaa sitten Calculate (laske). Oikeaan alanurkkaan ilmestyy labratuloksiin liittyviä arvoja. GD tarkoittaa muunnon aktiivisuutta. Jos siinä näkyy tähti, se tarkoittaa ettet muunna tarpeeksi tyroksiinia T3:ksi. GT:n kohdalla lukee ”ei laskettavissa”, koska olin laittanut T4-korvaushoidon kohdalle rastin. Ilman rastia siihenkin olisi ilmaantunut laskettu arvo. Alla esimerkki:

Ohjelman kehitti endokrinologi, tohtori Johannes W. Dietrich professori Hoermannin tutkimusryhmästä.
Endokrinologien tiedettä
Lähes kaikissa kilpirauhasta koskevissa teksteissä lukee, että kilpirauhashormonia T3 syntyy 20 % kilpirauhasessa ja 80 % muualla kehossa dejodinaation aikaansaamassa muunnossa, sekä että kilpirauhanen tuottaa hormoneja T4 ja T3 suhteessa 14:1.
Potilaat ovat etsineet lähteitä tähän, mutta vain yksi ainoa lähde on löytynyt (yleensä tieteessä sanotaan, ettei yksi lähde riitä): Pilon tutkimus vuodelta 1990.
Pilon ryhmä tutki kokonaista 14 kilpirauhasterveen ihmisen kilpirauhashormonituotantoa. Otanta oli niin pieni, että oikeasti arvoista ei voida laskea hajontaa. Jostain syystä osallistujille annettiin 56 kertaa suurempi annos jodia, kuin mitä nykyisin pidetään Yhdysvalloissa saannin ylärajana vuorokaudessa. Tämä on saattanut sotkea mittaustuloksia kautta linjan.
Koehenkilöiden arvot vaihtelivat laajalla skaalalla, eikä kilpirauhasen tuottama T4/T3 ollut tasan 14:1. Itse asiassa se vaihteli välillä 6,4 – 71,5. Muunnon osuus kokonais-T3-tuotannosta vaihteli 58 ja 93,5 prosentin välillä.
Kokosin tämän kirjoituksen kannalta mielenkiintoisimmat arvot taulukkoon. Siitä näkee, että vaihtelu yksilöiden välillä oli erittäin suurta. Koehenkilöt olivat siis terveitä, eikä tätä tutkimusta tehty lääkeannosten selvittämiseksi. Tästä ei mitenkään voi päätellä, että kilpirauhanen tuottaa tasan 5 ug T3:a vuorokaudessa, tai että tämä olisi suurin tarvittava lääkeannos korvaushoidossa. Mikäli kilpirauhanen on tuhoutunut eikä muunto toimi, ollaan lähempänä 20 – 40 ug vuorokausiannosta + imeytymishäviöt.

Koejoukosta siis mitattiin alkuparametrit verikokein ja mittauksin. Sitten heille annettiin radiojodilla merkittyä T4- ja T3-hormonia ja seurattiin niiden poistumista kehosta.
Taulukossa on merkitty paksulla mustalla suurimmat arvot ja punaisella pienimmät.
ETA:n suositus yhdistelmähoidosta vuodelta 2012 alkaa näin:
”Introduction
Hypothyroidism is a condition characterized by the clinical and biochemical manifestations of thyroid hormone deficiency in the target tissues of thyroid hormone. The most common cause of hypothyroidism is deficient production of thyroid hormones by the thyroid gland. Thyroxine (T4) is produced exclusively by the thyroid gland; its daily production rate is about 100 g at an average body surface area of 1.79 m 2 (56.2 g/day/m 2). Daily production rate of triiodothyronine (T3) for a body surface area of 1.79 m 2 is about 29 g (16 g/day/m 2): 20% ( 6 g, or 3.3 g/day/m 2 ) is secreted by the thyroid gland, and 80% ( 23 g, or 12.7 g/day/m 2) is generated in extrathyroidal tissues by 5 -deiodination of T4 [1]”
1 Pilo A, Iervasi G, Vitek F, Ferdeghini M, Cazzuola F, Bianchi R: Thyroidal and peripheral
production of 3,5,3 -triiodothyronine in humans by multicompartmental analysis. Am J
Physiol 1990;258:E715–E726.
Pilon tutkimusraportti on siis ETA:n suosituksen ensimmäinen kirjallisuusviite!
Pilon tutkimukseen ja ennen kaikkea sen soveltamiseen liittyvää kritiikkiä löytyy lisää englanniksi täältä: https://thyroidpatients.ca/?s=pilo&x=0&y=0&orderby=relevance&order=DESC
Kaikki kilpirauhasen vajaatoimintaan käytettävät lääkkeet ovat yhtä hyviä
Yhdysvaltain sotilaslääketieteen endokrinologit (Walter Reed Military Hospital) ovat pitkään tutkineet etenkin eläinperäisiä kilpirauhaslääkkeitä verrattuna tyroksiiniin.
Ensimmäinen tutkimusraportti julkaistiin vuonna 2013:
Desiccated thyroid extract compared with levothyroxine in the treatment of hypothyroidism: a randomized, double-blind, crossover study
Thanh D Hoang 1, Cara H Olsen, Vinh Q Mai, Patrick W Clyde, Mohamed K M Shakir
- PMID: 23539727
- DOI: 10.1210/jc.2012-4107
Siinä pieni potilasjoukko sai joko tyroksiinia tai eläinperäistä, kuivattua sian kilpirauhasuutetta. Kumpikin lääke oli yhtä hyvä ja vailla sivuvaikutuksia. 48,6 % potilaista piti eläinperäistä lääkettä parempana, kun taas 18,6 % piti tyroksiinia parempana.
Pian aloitettiin jatkotutkimus, jonka piti alun perin valmistua vuonna 2018. Siihen saatiin mukaan professori Antonio Bianco. Tutkimus valmistui lopulta tämän vuoden keväällä. Se esiteltiin endokrinologien keväisessä tapaamisessa maaliskuussa 2021. https://www.endocrine.org/news-and-advocacy/news-room/featured-science-from-endo-2021/combination-thyroid-hormone-therapies-treat-hypothyroidism-as-well-as-levothyroxine
Combination thyroid hormone therapies treat hypothyroidism as well as levothyroxine
Washington, DC March 20, 2021
Treatment should be individualized for common thyroid condition, researchers say
Haastattelussa endokrinologi Hoang kertoo, että kilpirauhasen vajaatoiminnan hoito pitää räätälöidä erikseen kullekin potilaalle. Käytettävissä ovat niin eläinperäinen valmiste, kuin synteettinen yhdistelmähoito ja tyroksiinimonoterapia. Ne ovat kaikki yhtä hyviä, ja vailla haittavaikutuksia.
Hoangin mukaan yhdistelmä on yhtä validi hoito kilpirauhasen vajaatoimintaan, kuin tyroksiini. Endokrinologi T. Hoang puolusti vahvasti myös eläinperäistä yhdistelmälääkettä. Uusi tutkimus julkaistaan lähiaikoina. Siinä 75 satunnaisesti valittua kilpirauhaspotilasta (blogistin huomio: parempi olisi ollut valikoida niitä, jotka eivät voi hyvin tyroksiinilla) oli jokainen 3 kk tyroksiinilla, 3 kk synteettisellä yhdistelmällä ja 3 kk eläinperäisellä kilpirauhaslääkkeellä. Koehenkilöistä vain 23 % piti tyroksiinia parhaana. 45 % piti eläinperäistä ja 32 % synteettistä yhdistelmää parhaana.
Itse tutkimusraportti julkaistiin 3. toukokuuta 2021. Se on huomattavan lyhyt. Ehkäpä yksityiskohdat julkaistaan myöhemmin?
J Endocr Soc. 2021 May 3; 5(Suppl 1): A827–A828.Published online 2021 May 3. doi: 10.1210/jendso/bvab048.1687 PMCID: PMC8090032
Desiccated Thyroid Extract Versus Synthetic LT4/T3 Combination Versus LT4 Monotherapy in the Treatment of Primary Hypothyroidism With Special Attention to the Thr92AlaD2 Polymorphism. With Special Attention to the Gene Polymorphism
Hashimoto- eli autoimmuunitulehduspotilaat pitivät muita useammin eläinperäistä lääkettä parempana kuin tyroksiinia tai synteettistä yhdistelmää. (Suomessa autoimmuunitulehdus on yleisin kilpirauhasen vajaatoiminnan aiheuttaja.) Tämä tutkimus oli satunnaistettu kaksoissokkotutkimus.
LISÄYS:
11 päivää tämän artikkelin julkaisun jälkeen julkaistiin laajempi tutkimusraportti:
https://academic.oup.com/jcem/advance-article/doi/10.1210/clinem/dgab478/6311304
Thanh Duc Hoang, DO,1Daniel I Brooks, PhD,1Antonio Bianco, MD,2Elizabeth A Mcaninch, MD,3Tatiana L Fonseca, PhD,2Vinh Q Mai, DO,5 and Mohamed K M Shakir, MD5
Endokrinologit, potilaat ja poliitikot kapinoivat

”Pienehköllä potilasryhmällä, noin 5-10 prosentilla, esiintyy jäännösoireita, vaikka verikokeet olisivat kunnossa. Tietenkin tämä voi joskus johtua muista vaivoista, mutta kilpirauhasen vajaatoiminta on somaattinen (ruumiillinen) sairaus, ei toiminnallinen häiriö”, sanoo endokrinologi Birte Nygaard.
Endokrinologit, potilaat ja poliitikot kapinoivat: ”Kilpirauhasen vajaatoimintaa ei pidä käsitellä toiminnallisena häiriönä”
Kirjoittaja Maiken Skeem 26.06.2020
Kilpirauhasyhdistyksessä ja endokrinologien piirissä ollaan suuttuneita potilaiden puolesta: Kilpirauhassairaus on ruumiillinen sairaus, ei toiminnallinen häiriö, ja sen vuoksi sitä ei pidä hoitaa alueellisissa toiminnallisten häiriöiden keskuksissa, potilaiden haitaksi. Kilpirauhasyhdistys on äskettäin, yhdessä yhden asiassa mukana olevan endokrinologin kanssa esittänyt Kansankäräjien terveysvaliokunnalle : Vastustajat suuttuivat asioiden kulun vuoksi.
Vuonna 2018 varattiin 17 miljoonaa Tanskan kruunua kilpirauhasen vajaatoiminnan parempaan hoitoon. Vuonna 2020 tähän tuli kuitenkin muutos: 5 miljoonaa kruunua tästä summasta tulisi käyttää toiminnallisten häiriöiden hoitoon. Päätettiin siis yhdistää kilpirauhasen vajaatoiminnan jäännösoireet, hoidosta huolimatta, toiminnallisiin häiriöihin.
Kilpirauhasen vajaatoiminta on hyvin määritelty fyysinen sairaus
Ennen kaikkea potilasyhdistys, ja endokrinologit potilaiden puolesta, ovat suuttuneita siitä, että kilpirauhaspotilaat nyt niputetaan yhteen toiminnallisista häiriöistä kärsivien potilaiden kanssa, siis potilaiden, joilla on oireita ilman todettua sairautta.
Birte Nygaard on Herlevin sairaalan endokrinologi (ja tunnettu kilpirauhastutkija), ja hän huomauttaa, että kilpirauhasen vajaatoiminta eli hypotyreoosi on hyvin määritelty fyysinen sairaus, joka diagnosoidaan verikokeiden avulla. Se ei ole toiminnallinen häiriö.
”Tanskassa on noin 150.000 kilpirauhasen vajaatoimintapotilasta. Ylivoimainen enemmistö heistä on hyvin hoidettuja ja voi hyvin. Mutta pienempi ryhmä potilaita, noin 5-10 % kokee jäännösoireita, vaikka verikokeiden tulokset näyttävät hyvältä. Tietenkin tämä voi johtua muista vaivoista, mutta hypotyreoosi on ruumiillinen, somaattinen sairaus, ei toiminnallinen häiriö. Mikäli esittäisin potilailleni, että he voivat tulla hoitoon toiminnallisten häiriöiden keskukseen, he pyytäisivät minua ottamaan heidät todesta.
Vaarana ongelmallinen selvitys
”On epäilemättä olemassa sellaisia vajaatoimintapotilaita, joilla mahdollisesti on myös toiminnallinen häiriö. Mutta on myös todennäköisesti ihmisiä, joilta on katkennut jalka, ja joilla on toiminnallinen häiriö. Kilpirauhasyhdistyksessä olemme loukkaantuneita potilaiden puolesta, ja pelkäämme myös, että siirtämällä tämän pienen potilasryhmän hoito maan toiminnallisten häiriöiden hoitokeskuksiin saadaan aikaan ongelmallinen potilaiden selvittely ja mahdollisesti jätetään taustalla olevat sairaudet huomioimatta. Oireet eivät katoa muulla kuin oikealla lääkehoidolla, eikä siis voida parantaa esim. B12-vitamiinin puutosta sairauden hallintastrategioilla. Tulisi yksinkertaisesti liian helpoksi lokeroida meidät toiminnallisten häiriöiden lokeroon.”
Lukuisista kyselyistä huolimatta kukaan ei ole pystynyt kertomaan potilasyhdistykselle tai endokrinologeille, kuka teki tämän päätöksen, että varat (5 miljoonaa kruunua) pitäisi laittaa toiminnallisten häiriöiden keskuksiin.
Sundhedspolitisk Tidsskrift-lehti on tässä asiassa lähettänyt Terveyshallitukselle kyselyn, jotta asiaan saataisiin selvyys. Sundhedsstyrelsen tukee päätöstä liittää kilpirauhasen vajaatoimintapotilaiden pieni ryhmä toiminnallisten häiriöiden keskusten alaisuuteen. Saimme seuraavan vastauksen ylilääkäri ja suunnitteluosaston osastopäällikkö Lotte Klitfodilta:
”Terveyshallituksessa myönnämme tietenkin, että kilpirauhasen vajaatoiminta on somaattinen sairaus, ja että sairaus kuuluu endokrinologian erikoisalaan. Valitettavasti on olemassa potilasryhmä, joka ei lääketieteellisesti oikeasta hoidosta huolimatta endokrinologien alaisuudessa voi hyvin, ja joille ei voida laboratoriokokein osoittaa muuta syytä heidän jäännösoireilleen. Näiltä potilailta puuttuu nyt hyvä mahdollisuus hoitoon. Jälkioireista kärsiville potilaille voi, diagnoosista riippumatta, olla hyötyä avusta sairauden hallinnassa. Potilaat voivat näin saavuttaa paremman toiminnallisen tason ja paremman elämänlaadun. Toiminnallisten häiriöiden keskuksilla on paljon kokemusta sairauden hallinnan auttamisesta, ja olemme siksi sitä mieltä, että keskukset voivat yhteistyössä endokrinologian osastojen kanssa olla hyödyksi sellaisille kilpirauhaspotilaille, jotka kärsivät vajaatoiminnan jäännösoireista. Toivomme siksi, että varat auttaisivat suurempaa potilasjoukkoa saamaan hyvää hoitoa.”
Lääkintöhallituksen vaatimukset eivät vaikuta kohtuullisilta
Tällä yritetään ilmeisesti torpata eläinperäisten lääkkeiden tutkiminen.)
”Sen lisäksi, että puhutaan kohtuuttoman lyhyestä hakemusajasta, endokrinologian osastot eivät yksinään voi hakea rahoitusta, vaan niiden on tehtävä yhteistyötä toiminnallisten häiriöiden hoitokeskusten kanssa. Näille kerrottiin rahoituksesta viikkoa ennen rahoituksen haun julkaisemista, kun taas endokrinologian osastoille ei ole kerrottu asiasta etukäteen. Tämä näyttää harkitulta esteeltä hakemusprosessille, jossa hakuaika on kovin lyhyt. Olisi voitu esimerkiksi varoittaa Tanskan kilpirauhaslääkäreiden liittoa samalla, kun asiasta kerrottiin toiminnallisten häiriöiden keskuksilla. Nyt ne ovat saaneet etumatkaa, kun taas endokrinologeille viritettiin ansa.”
Terveysvaliokunta kuunteli tarkkaan
”He olivat oikeasti järkyttyneitä siitä, ettei meille ollut kerrottu enempää asiassa, ja he puistivat päätään sille, että selässämme lukee nyt ”toiminnallinen häiriö”. Erityisesti Liselott Blixt (DF), joka on perusteellisesti perehtynyt asiaan, oli loukkaantunut asioiden kulusta.”
Sundhedspolitisk Tidsskrift-lehti tapasi Liselott Blixtin heti terveysvaliokunnan kokouksen jälkeen. Hän oli selvästi ärtynyt kilpirauhaspotilaiden tilanteesta:
”Suutuin todella siitä, että asia on edennyt näin hitaasti. Se osoittaa vain sen, että kun hallitus vaihtuu, niin aiemmin tehdyt sopimukset eivät pidä. Minulla oli selvä sopimus aiemman terveysministerin, Ellen Trane Nørbyn (V) kanssa siitä, että 17 miljoonaa kruunua piti varata kilpirauhasen vajaatoimintapotilaille, mutta ymmärrän nyt tämän päivän terveysvaliokunnan kokouksen jälkeen, ettei näin ole tapahtunut uuden hallituksen astuttua virkaansa. Näyttää lähinnä siltä, että Terveyshallituksessa on haluttu kampittaa kilpirauhaspotilaita. Tämä ei ole hyväksyttävää, ja toivomme nyt voivamme vaikuttaa istuvaan hallitukseen, jotta kampitus päättyisi.”
Onko kilpirauhasen vajaatoiminta toiminnallinen vaiva?
Tanskan viranomaiset julkaisivat keväällä tiedotteen, jonka mukaan sairaalat voivat hakea rahaa perustaakseen kilpirauhaspotilaille sairautta käsitteleviä kouluja toiminnallisten vaivojen laitosten alaisuuteen. Erään tanskalaisen potilasjärjestön puheenjohtaja, Anett Kromann, sai tänään julki mielipidekirjoituksen terveyspoliittisessa aikakauslehdessä. https://sundhedspolitisktidsskrift.dk/meninger/kommentarer/3459-endnu-en-gang-traeffes-der-besynderlige-beslutninger-pa-stofskifteomradet.html
Jälleen kerran tehtiin omituinen päätös kilpirauhassairauksien alueella
Anett Kromann 8. kesäkuuta 2020
Keskustelu

Anett Kromann, Foreningen StofskifteSupport
MIELIPIDE: Minkä takia alueelliset toiminnallisten häiriöiden keskukset liitetään kilpirauhassairauksien rahoitukseen? Se vastaisi sitä, että diabeteskoulut olisivat toiminnallisten häiriöiden keskusten alaisuudessa, sillä diabetes ja kilpirauhassairaudet ovat molemmat endokrinologisia sairauksia, kirjoittaa Anett Kromann, Foreningen StofskifteSupport, tässä mielipidekirjoituksessa.
Lokakuussa 2018 varattiin 5 miljoonaa Tanskan kruunua kilpirauhassairauksien lääketieteelliseen tutkimukseen. Tämä syntyi seurauksena poliittisesta sopimuksesta hallituksen ja Tanskan kansanpuolueen välillä. Rahaa annettiin terveydenhoidon korkealle priorisoiduille toimenpiteille, joista kilpirauhassairaudet oli yksi osa.
Tiedämme, että rahaa on annettu alan lääketieteellisiin tutkimuksiin, mutta yhdistystä StofskifteSupport ei ole informoitu siitä, mihin asti tutkimuksissa on päästy, tai onko niitä käynnissä.
5 miljoonaa on osa 17 miljoonan kruunun kokonaisuudesta, joka myönnettiin kilpirauhassairauksien tehostettuun hoitoon.
Osana aloitteista näkyy:
”Perustetaan potilaskouluja lisäämään potilaiden ymmärrystä heidän sairaudestaan, elämästä kroonisen sairauden kanssa ja heidän elämänsä aikana kokemista mahdollisista oireista tai vaivoista.”
Asetettu toiminnallisten häiriöiden alaisuuteen
28. toukokuuta 2020 kerrotaan seuraavaa Terveyshallituksen kotisivulla:
5 miljoonaa kruunua kilpirauhasen vajaatoiminnan oireista kärsiville potilaille. ”Tästä päivästä lähtien lääketieteelliset osastot voivat hakea varoja poikkitieteellisiin hoitoihin sellaisille potilaille, joilla on jäljellä kilpirauhasen vajaatoiminnan oireita. Heille jotka eivät saa apua lääkkeistä.” Ja siteerataan osastopäällikkö Lotte Klitfodia: ”Alueellisissa toiminnallisten häiriöiden keskuksissa on asiantuntemusta auttaa tätä potilasryhmää, ja toivomme että varatut rahat voisivat auttaa kehittämään mallin, joka voidaan ottaa käyttöön koko maassa.”
Tämä rahoitus, jota voivat hakea vain sairaaloiden endokrinologit, koskee siis toiminnallisia häiriöitä, ryhmää johon kilpirauhassairaudet eivät kuulu. Moni potilas kokee oireita, vaikka laboratoriokokeiden tulokset olisivatkin normaalit. Oireet eivät katoa muuten kuin oikealla lääkityksellä.
Kilpirauhasen vajaatoiminnasta kärsivät saavat yleensä T4-lääkettä, joka on esihormonia. Tämän esihormonin pitää kuitenkin elimistössä muuntua aktiiviseksi T3-hormoniksi. Mikäli näin ei tapahdukaan eri syistä, voi seurauksena ilmetä monia elämää häiritseviä oireita. Kysymys kuuluukin, onko perinteinen lääke tarpeeksi hyvä.
Kyseessä on yleensä autoimmuunisairaus, joka todetaan verikokeilla
Autoimmuuni kilpirauhastulehdus (Hashimoton kilpirauhastulehdus) joka on kilpirauhasen vajaatoiminnan yleisin syy, todetaan verikokeella. Autoimmuunisairaus voi aiheuttaa lukuisia oireita, ennenkuin varsinainen kilpirauhasen vajaatoiminta on syntynyt. Terveydenhoitojärjestelmä ei huomioi autoimmuunisairautta, vaan odottaa selvän vajaatoiminnan ilmenemistä. Tämän rajapinnan tarkempi tutkimus olisi hyödyllistä.
Kilpirauhaspotilaina oletimme, että asiaa tutkittaisiin lääketieteellisesti. Emme suinkaan odottaneet että meidät pistettäisiin toiminnallisten vaivojen osaksi, jolla ei ole mitään tekemistä sairauden fyysisten ja psyykkisten oireiden kanssa (jotka usein johtuvat väärästä lääkehoidosta).
Århusin yliopistosairaalan mukaan toiminnallisen häiriön määritelmä on: ”Toiminnallinen häiriö on yhteinen nimitys ryhmälle sairauksia, joissa potilas kokee fyysisiä oireita tai on huolissaan fyysisistä oireista, jotka vaikeuttavat jokapäiväistä toimintaa. Näitä oireita ei voida liittää toiseen tunnettuun ja hyvin määriteltyyn diagnoosiin.”
Tästä käy selvästi ilmi, etteivät kilpirauhaspotilaat kuulu tähän ryhmään. Asia koskee maanlaajuisesti 152.350 ihmistä, jotka eivät saa oireisiinsa apua. Luku on vuodelta 2017, ja uskomme että heitä on nyt paljon enemmän.
Monissa Terveyshallinnon kokouksissa, joihin yhdistys StofskifteSupport osallistui, vallitsi laaja yksimielisyys siitä, että kilpirauhassairaudet ovat fyysisiä sairauksia, jotka todetaan verikokeilla.
Kuuluvatko diabeteskoulut toiminnallisten häiriöiden aluekeskusten alaisuuteen?
Ylläolevilla perusteilla on hyvin vaikeaa ymmärtää, että kilpirauhassairaudet kytketään toiminnallisten häiriöiden aluekeskuksiin. Toiminta vastaa sitä, että diabeteskin liitettäisiin niihin. Diabetes ja kilpirauhassairaudet kuuluvat endokrinologian alaisuuteen.
Olemme erittäin iloisia siitä, että kilpirauhassairaiden hoitoon ja diagnosointiin kiinnitetään enemmän huomiota. Koemme kuitenkin ongelmaksi, että sairaus, jota ei tunnetusti ole tutkittu läheskään tarpeeksi, tällä tavalla asetetaan aivan eri sairausnimikkeen alaisuuteen. Olemme erittäin huolissamme siitä, että tästä muodostuu este sen selvittämiselle, mitä voidaan lääkkeellisesti tehdä sairauden hoidon parantamiseksi. Tämä koskee erityisesti Hashimoton autoimmuunitulehduksesta kärsiviä, sillä Hashimoton autoimmuunitulehdus on yleisin syy kilpirauhasen vajaatoimintaan.
Tyroksiini kuin tyroksiini?
Merck valmistaa T4-valmistetta nimellä Levothyrox, joka tunnetaan myös nimellä Euthyrox. Se oli muutama vuosi sitten ainoa Ranskassa myytävä tyroksiinivalmiste. Sitten tapahtui kummia: lääkkeen koostumusta muutettiin, ja potilaat alkoivat valittaa ettei lääke enää auta heitä. Asiasta ei ilmoitettu etukäteen, ja vasta kaivamisen jälkeen muutos tuli ilmi. Ranskan viranomaiset olivat vaatineet koostumuksen muuttamista.
Tämän jälkeen Ranskan markkinoille on tullut muitakin tyroksiinivalmisteita.
Näytti siltä, että muutettu valmiste tulisi myyntiin myös Ruotsissa. Tämä sai ruotsalaiset potilaat hermostumaan. Ruotsin myydyin tyroksiinivalmiste on Takedan Levaxin, jolla on viime vuosina ollut toimituskatkoksia. Valmiste on nyt myynnissä Ruotsissa.
Merck teetti tutkimuksen uudella ja vanhalla koostumuksella. Koehenkilöille annettiin kerralla 600 ug T4, vanhaa valmistetta ja uutta. T4-pitoisuus mitattiin sitten 72 tunnin kuluttua lääkkeen otosta.
Artikkeliin on tullut useita kommentteja, joista yksi on aivan tuore Hoermannin tutkijaryhmältä.
https://doi.org/10.1007/s40262-020-00887-x
Ryhmä piirsi kuvan alkuperäisistä mittaustuloksista:

Jokainen pystyviiva edustaa yhtä potilasta, sininen piste pitoisuutta vanhalla koostumuksella ja punainen uudella. Joillakin potilailla pitoisuudet olivat suunnilleen samat, toisilla hyvin erilaiset. Vaihtelu on myös suurta potilaiden välillä.
Pitäisi selkeämmin ottaa huomioon jokaisen potilaan yksilölliset ominaisuudet, kuten lääkkeen imeytyminen.
Merck tuomittiin toimittamaan vanhan koostumuksen lääkettä sellaisille ranskalaisille potilaille, joita uusi koostumus ei auta.
Artikkelia selostetaan myös täällä: https://www.tandfonline.com/doi/abs/10.1080/03007995.2016.1246434
Tänään tanskalainen potilasyhdistys kirjoittaa, että vanhaa koostumusta ei saa enää ollenkaan 4.5.2020 jälkeen. https://stofskiftesupport.dk/medier/euthyrox-ny-formulering/ Ruotsi ja Norja haluavat siirtyä uuteen versioon heti pääsiäisen jälkeen.
Tanskalaisten luettelo rinnakkaistuontilääkkeistä ja niiden eränumeroista:
https://stofskiftesupport.dk/medicin-lavt-og-hoejt-stofskifte/parallelimport-af-euthyrox-eltroxin/
Wiersinga: T4 + T3-yhdistelmähoito: onko nähtävissä edistystä?
Endocrine (2019) 66:70–78
https://doi.org/10.1007/s12020-019-02052-2
KATSAUS
T4 + T3-yhdistelmähoito: onko nähtävissä edistystä?
Wilmar M. Wiersinga1
Vastaanotettu: 15. heinäkuuta 2019 / Hyväksytty: 5. elokuuta 2019 © Tekijä (t) 2019
Yhteenveto
T4 + T3-yhdistelmähoidon hoitosuositus julkaistiin vuonna 2012. Tässä katsauksessa selvitetään, ymmärretäänkö asia paremmin 7 vuotta myöhemmin. Tyytymättömyys T4-monoterapiaan on edelleen suurta. Pysyvät oireet koostuvat pääasiassa väsymyksestä, painonnoususta, muistin ja ajattelun ongelmista sekä mielialan häiriöistä. T4-monoterapia liittyy alhaisiin seerumin T3-tasoihin, jotka vaativat usein TSH:ta alle viitealueen painavia L-T4-annoksia T3-V:n normalisoimiseksi. Perifeerisen kudoksen kilpirauhasen toimintakokeet T4-hoidon aikana osoittavat lievää kilpirauhasen liikatoimintaa TSH:lla <0,03 mU/l, ja lievää kilpirauhasen vajaatoimintaa TSH:lla 0,3-5,0 mU/l; kudokset ovat lähinnä eutyreoosia, kun TSH on välillä 0,03-0,3 mU/l. Tämä selittyy löydöksellä, jossa todetaan, että vaikka T4 yleensä ubikitinoituu ja sitä kautta hajoaa, hypotalamuksen T4 on melko vakaa ja vähemmän herkkä ubikitinaatiolle ja hajoamiselle. Normaali seerumin TSH ei siksi välttämättä osoita eutyreoosia. Pysyvät oireet LT4:llä hoidetuilla potilailla ymmärretään puutteellisesti normaalista seerumin TSH:sta huolimatta. Yksi hypoteesi on, että DIO2-geenissä, (jota tarvitaan T3:n paikalliselle muunnolle T4:stä) oleva muunnos, SNP (Thr92Ala), häiritsee sen kinetiikkaa ja/tai vaikutusta, johtaen aivojen paikalliseen kilpirauhashormonin puutteeseen. Pysyvien oireiden tehokasta hoitoa ei ole vielä toteutettu. T4 + T3 -yhdistelmähoitoa voidaan kokeilla valituilla potilailla kokeellisena n =1-tutkimuksena. Vuoden 2012 ETA-hoitosuositus pätee edelleen tähän tarkoitukseen. Hyvin suunnitellut satunnaistetut kliiniset tutkimukset valituilla potilailla ovat avainasemassa edistymisen saavuttamiseksi. Tänä aikana koko asia on monimutkaistunut kaupallisten ja poliittisten vaikutusten takia, mikä käy ilmi T3-tablettien hintojen kovasta noususta Britanniassa, aggressiivisista painostusryhmistä ja Britannian ylähuoneessa tehdyistä esityksistä.
Wilmar M. Wiersinga
wmwiersinga@amc.uva.nl1
Endokrinologian ja aineenvaihdunnan laitos, Akateemisen lääketieteen keskus, Amsterdamin yliopisto, Amsterdam, Alankomaat
Avainsanat: Hypotyreoosi ● Yhdistelmähoito ● T4 ● T3
Johdanto
Vuonna 2012 Euroopan kilpirauhaslääkärien yhdistys (ETA) julkaisi ensimmäisen hoitosuosituksen T4 + T3-yhdistelmähoidosta kilpirauhasen vajaatoiminnassa [1]. Nyt on kulunut seitsemän vuotta, ja mietin, onko asiassa edistytty. Haluaisin käsitellä tätä kysymystä esittämällä samat kysymykset kuin vuoden 2012 hoitosuosituksissa esitettiin.
Onko L-T4:llä hoidetuilla kilpirauhasen vajaatoimintapotilailla tyydyttämätöntä hoitotarvetta?
Vuonna 2012 ilmoitettiin, että 5-10%:lla levotyroksiinilla (L-T4) hoidetuista kilpirauhasen vajaatoiminnasta kärsivistä potilaista, joilla oli normaali seerumin TSH, oli kilpirauhassairauteen ja L-T4-terapiaan liittyviä oireita (heikentynyt elämänlaatu, psykologinen stressi ja kognitiiviset häiriöt) [1]. Tämä lausunto perustui kolmeen väestöpohjaiseen tutkimukseen Yhdistyneestä kuningaskunnasta, Alankomaista ja Norjasta [2 – 4]. Sen jälkeen väestössä ei ole enää tehty tutkimuksia, mutta vuonna 2017 American Thyroid Association (ATA) -sivustolla (Yhdysvaltain kilpirauhaslääkärien yhdistys) julkaistu kilpirauhasen vajaatoimintapotilaiden kyselytutkimus osoitti huomattavaa tyytymättömyyttä hoitoon [5]. Niiden vastaajien keskuudessa, joilla ei ollut heidän itse ilmoittamaansa masennusta, elämän stressitekijöitä tai sairauksia (n = 3670), tyytyväisyys asteikolla 1-10 L-T4:llä oli 5 (IQR 3-7), tyytyväisyys L -T4 + L-T3:llä oli 6 (IQR 3-8), ja tyytyväisyys potilailla, jotka käyttivät kuivattua kilpirauhasuutetta (DTE), oli korkein (pistemäärä 7, IQR 5-9) (p <0.0001). Niiden joukossa, jotka olivat tyytymättömiä hoitoonsa (~ 22% vastaajista, jotka ottivat L-T4:ta tai L-T4 + L-T3:ta, ja 14% DTE:n käyttäjistä), asiaankuuluvat alueet, joiden tunnistettiin aiheuttavan tyytymättömyyttä, oli väsymys tai energiataso (77%), painonhallinta (69%), muisti tai muut älylliset ongelmat (58%) ja mieliala (45%) [5]. Kyselyn tulokset ovat todennäköisesti harhaisia, koska tyytymättömät potilaat ovat todennäköisemmin osallistuneet tutkimukseen kuin potilaat, jotka olivat tyytyväisiä hoitoonsa. Toinen harha saattaa olla suhteellisen suuri subkliinisen kilpirauhasen vajaatoiminnan osuus osallistujien keskuudessa, koska viime vuosikymmeninä tyroksiinin korvaaminen on aloitettu vähitellen aiempaa alhaisemmilla seerumin TSH-pitoisuuksilla (vuonna 2009 keskimääräisen TSH: n ollessa 7,9 mU/l) [6]. Viimeaikaiset tutkimukset eivät ole osoittaneet kilpirauhaseen liittyvien oireiden lievenemistä tai elämänlaadun paranemista subkliinisen kilpirauhasen vajaatoiminnan levotyroksiinihoidon jälkeen, etenkään vanhemmilla henkilöillä [7 – 9]. Tyytymättömyys hoidon lopputulokseen voisi siten liittyä monien subkliinistä kilpirauhasen vajaatoimintaa sairastavien vanhempien potilaiden osallistumiseen kyselytutkimukseen.
Onko L-T4: llä hoidettujen kilpirauhasen vajaatoimintapotilaiden valituksille olemassa biologinen peruste?
Vuonna 2012 havaittiin viisi mahdollista syytä jatkuville valituksille [1].
1. Taudin krooniseen luonteeseen liittyvät epäspesifiset syyt
Tietoisuus kroonisesta sairaudesta ja kilpirauhaslääkkeiden elinikäisestä riippuvuudesta voivat tehdä potilaista onnettomia ja vähemmän terveitä [1]. Ei ole tehty eteneviä tutkimuksia, joiden avulla olisi testattu hypoteesia siitä, eroavatko potilaiden asenteet, terveyskäsitykset ja mieliala ennen L-T4-hoitoa heillä, joilla on jäljellä oireita heistä, joilla ei ole jäännösoireita hoidon jälkeen. Laadulliset haastattelututkimukset osoittavat, että potilailla on yleensä heikko ymmärrys tilastaan [10]. Kun he kokevat kilpirauhasen vajaatoiminnan oireita alkuperäisen diagnoosin yhteydessä, tautiherkkyyden tunne (ja sitoutuminen L-T4:ään) on parempi, mutta potilaat, jotka voivat huonosti normaalista seerumin TSH-arvosta huolimatta, tunsivat jäävänsä ilman jatkoselvittelyjä normaalin laboratoriotuloksensa vuoksi. Yleislääkärien ja hoitajien keskuudessa tehdyt laadulliset tutkimukset ovat paljastaneet riittämätöntä osaamista lääkkeiden keskinäisvaikutuksista ja levotyroksiinin farmakokinetiikasta [11]. Ammattilaiset luottavat enemmän verikokeiden tuloksiin kuin kliinisiin oireisiin tyroksiiniannoksen säätämisessä. Tietojen vaihtoa rajoittaa yleensä aika ja se keskittyy usein oireisiin eikä potilaan koulutukseen. Huonon lääkehoidon suurimmaksi syyksi todettiin potilaiden heikko sitoutuminen lääkehoitoon, vaikka muutkin tekijät, kuten muut sairaudet ja lääkitykset mainittiin. Tästä seuraa, että lääkäreiden ja potilaiden vuorovaikutuksen parantaminen voisi vähentää kilpirauhasen optimaalisen lääkehoidon esteitä.
2. Liittyvät autoimmuunisairaudet
Liittyviä autoimmuunisairauksia esiintyy 14%: lla potilaista, joilla on Hashimoton tauti, ja 10%:lla potilaista, joilla on Basedowin tauti [12]. Ei tiedetä, kuinka usein jäljelle jääneet oireet johtuvat huomioimatta jääneistä liittyvistä autoimmuunisairauksista.
3. Kilpirauhasen autoimmuniteetti itsessään
On edelleen epäselvää, johtuvatko tietyt oireet kilpirauhasen autoimmuniteetista itsestään. Esimerkiksi pelkästään TPO-vasta-aineiden esiintyminen muuten eutyreoottisissa henkilöissä on liitetty masennukseen joissakin väestöpohjaisissa tutkimuksissa, mutta ei toisissa [1]. Kilpirauhasen antigeenien täydellinen poisto täydellisellä tyreoidektomialla (kilpirauhasen poistoleikkaus) aiheuttaa kilpirauhasen vasta-aineiden asteittaisen häviämisen. Jotta voitiin selvittää, parantavatko tyreoidektomiat oireita, jotka jatkuivat Hashimoton kilpirauhastulehduksesta kärsivillä potilailla, vaikka heillä oli normaalit kilpirauhasen toimintakokeet samalla, kun he saivat kilpirauhashormonikorvaushoitoa, tehtiin satunnaistettu kliininen tutkimus, jossa verrattiin täydellistä tyreoidektomiaa lääkehoidon jatkamiseen [13]. Täydellinen tyreoidektomia paransi terveyteen liittyvää elämänlaatua ja väsymystä, kun taas lääkehoito ei parantanut niitä. 18 kuukauden kohdalla mediaani-TPO-Ab-arvot laskivat 2232:sta 152 kU/l:aan leikkausryhmässä ja 2052:sta 1300 kU/l:aan lääkehoitoa saaneessa ryhmässä.
4. L-T4-annoksen riittämättömyys
Aikaisempien tutkimusten mukaan L-T4:ää käyttävillä NHANES-tutkimuksen osallistujilla, joilla oli normaali seerumin TSH, seerumin kokonaisen ja vapaan T4:n pitoisuudet ovat korkeammat, ja kokonaisen ja vapaan T3:n pitoisuudet matalammat kuin terveillä tai vastaavilla verrokeilla [14]. Alle viiterajan olevia T3-V-arvoja havaitaan noin 15%:lla levotyroksiinia saavista kilpirauhasen vajaatoiminnasta kärsivistä potilaista [15]. Siksi voidaan kysyä, voisiko matala seerumin T3-taso olla syynä jäännösoireille, ja edellyttääkö se suurempia L-T4-annoksia T3-tasojen normalisoimiseksi. Tämä ei kuitenkaan vaikuta kovin todennäköiseltä. Hieman pienemmät tai korkeammat L-T4-annokset eivät tuottaneet mitattavissa olevia muutoksia kilpirauhasen oireissa, hyvinvoinnissa tai elämänlaadussa [16, 17], eikä merkittäviä eroja aineenvaihdunnassa [18]. Toisessa tutkimuksessa arvioitiin täydellisen tyreoidektomian vaikutusta, joka poistaa kilpirauhasen T3-erityksen kokonaan [19]. Leikkauksen jälkeisiä T3-V-tasoja tyroksiinihoidon aikana verrattiin ennen leikkausta vallinneeseen seerumin T3-V-tasoon samoilla yksilöillä: leikkauksen jälkeinen T3-V oli korkeampi kuin ennen leikkausta potilailla, joilla leikkauksen jälkeinen TSH oli <0,03 mU/l, muuttumaton potilailla, joilla leikkauksen jälkeinen TSH oli 0,03-0,3 mU/l ja alempi potilailla, joilla on leikkauksen jälkeinen TSH 0,3-5,0 mU/l [19]. Nämä tutkimukset viittaavat siihen, että tarvitaan tyroksiinin TSH-suppressiivisia annoksia seerumin T3-tasojen pitämiseksi samanlaisina kuin ennen kilpirauhasen poistoa. Se tarjoaa perustelun T3-korvaushoidolle [20]. Ei kuitenkaan ole olemassa hyvää näyttöä siitä, että alhainen seerumin T3-V tai alhainen T3-V / T4-V-suhde olisi yhteydessä pysyviin oireisiin. Alhaisesta seerumin T3-V:sta L-T4-hoidon aikana vastuussa oleva mekanismi liittyy tyypin 2 dejodinaasiin (DIO2). Tämä entsyymi katalysoi T4:n dejodinaatiota T3:ksi kilpirauhasen ulkopuolisissa kudoksissa ylläpitäen siten seerumin T3-tasoja tyroksiinihoidon aikana. DIO2:lla on lyhyt puoliintumisaika (≈60 min.), joka lyhenee edelleen (20 min) vuorovaikutuksessa T4:n kanssa, mikä johtaa DIO2:n ubikitinaatioon ja proteosomaaliseen hajoamiseen [21]. Hypotalamuksen DIO2 on, toisin kuin muut kudokset, melko vakaa ja vähemmän herkkä ubikitinaatiolle [22]. Siten, kun muussa kehossa DIO2-välitteinen T3-tuotanto vähenee asteittain kasvavilla L-T4-annoksilla DIO2:n ubikitinaation vuoksi, hypotalamuksen/aivolisäkkeen T3-tuotanto ei vähene, ja seerumin TSH:n normalisoimiseksi tarvittava L-T4-annos on pienempi kuin seerumin T3:n normalisoiva annos. Tästä seuraa, että normaalin seerumin T3-V-tason saavuttamiseksi on annettava suhteellisen suuri L-T4-annos, joka todennäköisesti painaaa seerumin TSH:n hyvin matalaksi.
5. L-T4-hoitomuodon riittämättömyys
Taulukko 1 Perifeerisen kudoksen kilpirauhasen toimintakokeet 133 potilaalla ennen täydellistä tyreoidektoomiaa ja vuosi leikkauksen jälkeen L-T4-lääkityksellä [ 23 ] LDL-C LDL-kolesteroli, SHBG sukuhormoneja sitova globuliini, TRACP tartraattiresistentti hapan fosfataasi, BAP luun alkalinen fosfataasi, NS ei merkitsevä, ↓ merkitsevä pudotus, ↑ merkitsevä nousu, preop ennen leikkausta, postop leikkauksen jälkeen |
Perifeerisen kudoksen kilpirauhasen toimintakokeet tyroksiinihoidolla on arvioitu ennen täydellistä tyreoidektomiaa ja vuosi leikkauksen jälkeen [23]. Potilailla, joilla leikkauksen jälkeinen oli TSH ≤ 0,03 mU/l, oli lievä liikatoiminta kudostasolla, potilailla, joiden TSH oli välillä 0,03 – 0,3 mU/l, perifeeristen kudosten toimintakokeet olivat lähinnä eutyreoosia ja potilailla, joilla TSH oli välillä 0,3-5,0 mU/l, potilaalla oli lievä kudoksen kilpirauhasen vajaatoiminta (taulukko 1). L-T4:n korvaaminen annoksilla, jotka normalisoivat seerumin TSH:n, ei normalisoi kaikkia kilpirauhashormonin signaloinnin systeemisiä markkereita, mukaan lukien seerumin LDL-kolesteroli ja kokonaiskolesteroli [24]. Normaali seerumin TSH ei siis ole tae kaikissa kohdekudoksissa esiintyvästä eutyreoosista [15, 25]. On pääteltävä, että L-T4 -hoito ei kykene aikaansaamaan eutyreoosia samanaikaisesti kaikissa kohdekudoksissa. Juuri se johtopäätös, jonka Escobarit tekivät heidän nykyisin tunnetuissa kokeissaan kilpirauhashormonin korvaamisesta kilpirauhasen vajaatoiminnassa: vain L-T4+L-T3-yhdistelmä voi varmistaa samanaikaisen eutyreoosin kaikissa kudoksissa [1]. Vaikka L-T4 ei ehkä ole ihanteellinen kilpirauhashormonin korvaushoito, suurin osa potilaista on tyytyväinen sen tulokseen. Ei ymmärretä, miksi osa potilaista kokee jatkuvia oireita. On oletettu, että kyseessä on tietty yksittäisen nukleotidin polymorfismi (SNP) DIO2:ssä, nimittäin Thr92Ala. Mielenkiinto tähän snippiin heräsi varhaisesta löydöstä, että Thr92Ala liittyi heikentyneeseen psyykkiseen hyvinvointiin tyroksiinimonoterapialla ja parempaan vasteeseen T4+T3-yhdistelmäterapialla [26]. Jopa 80% aivojen solunsisäisestä T3:sta syntyy T4:n paikallisesta dejodinaatiosta T3:ksi, jota katalysoi D2. Eräät tutkimukset osoittavat vähentynyttä D2-aktiivisuutta Thr92Ala:n läsnä ollessa [27], mutta toiset huomioivat SNP:n normaalia entsyymikinetiikkaa [28]. Hollantilainen väestöpohjainen tutkimus raportoi, että tämän D2-polymorfismin Ala/Ala-genotyyppi esiintyy 11,3%:lla T4:n käyttäjistä ja 10,7%:lla koko väestöstä; kummassakaan ryhmässä SNP ei liity seerumin TSH:n, T4-V:n, T3-V:n tai T3-V/T4-V-suhteen eroihin, terveyteen liittyvään elämänlaatuun eikä kognitiiviseen toimintaan [29]. Äskettäin Thr92Ala-proteiiniin liittyviä solujen poikkeavuuksia on tutkittu edelleen. Proteiinin Ala92-version puoliintumisaika on pidempi kuin villityypin, se sijaitsee ektooppisesti (poissa normaalilta paikaltaan) Golgin laitteessa ja muuttaa ihmisten aivojen tiettyjen alueiden geneettistä profiilia tavalla, joka muistuttaa neurodegeneratiivista sairautta, ilman todisteita vähentyneestä kilpirauhashormonin signaloinnista [30]. Viimei-simmän tutkimusraportin mukaan D2 on kuljettajaproteiini, joka kierrättää ER:n (endoplasminen retikulum, solulimassa oleva onteloinen kalvosto, solulimakalvosto) ja Golgin laitteen välillä [31]. Thr92-Ala-substituutio aiheuttaa ER-stressiä, aktivoi laskostumattoman proteiinin vasteen (UPR), kertyy trans-Golgiin ja tuottaa vähemmän T3:ta. Hiirellä, jolla on Ala92 DIO2-muunnos, esiintyy UPR:aa ja kilpirauhashormonien puutetta eri aivoalueilla, kun taas ulkopuolelta annettu L-T3 parantaa älyllistä suoriutumista. Primääri kilpirauhasen vajaatoiminta vahvistaa Ala92 DIO2 -fenotyyppiä, vastaten vain osittain tyroksiiniin. On pääteltävä, että edelleen ymmärretään huonosti jatkuvien valitusten alkuperä L-T4: llä hoidetuilla kilpirauhasen vajaatoiminnasta kärsivillä potilailla, joilla on normaali seerumin TSH. Toisaalta voidaan myös päätellä, että L-T4-monoterapia ei todennäköisesti ole ihanteellinen tapa korvata kilpirauhashormonien puute. Endokrinologien keskuudessa vuonna 2013 tehdyssä tutkimuksessa kävi ilmi, että kun potilailla oli pysyviä oireita TSH-tavoitearvojen saavuttamisesta huolimatta, 84% vastaajista testasi muita syitä, 11% lähetti potilaan perusterveydenhoitoon ja 3,6% vaihtoi L-T4+L-T3-yhdistelmään; 22% mittasi T3-V:n [32].
Onko todisteita siitä, että L-T4+L-T3-yhdistelmähoito auttaa kilpirauhaspotilaita paremmin kuin L-T4-monoterapia?
Vuoden 2006 meta-analyysissä, jossa 11 RCT:ssä (satunnaistettu kontrolloitu tutkimus) verrattiin L-T4-monoterapiaa L-T4+L-T3-yhdistelmähoitoon, ei löytynyt eroja eri lopputuloksissa (elämänlaatu, kognitio, mieliala tai oireet) [1]. Haittavaikutukset eivät myöskään eronneet hoitojen välillä. Viimeisimmässä RCT:ssä ei myöskään ole eroja [33]. Monia, ellei kaikkia RCT-tutkimuksia, voidaan kritisoida monissa suhteissa, esimerkiksi valintaharhasta, joka johtuu etiologialtaan ja ennusteeltaan heterogeenisten potilasryhmien sisällyttämisestä koejoukkoon, todellisen vaikutuksen laimentamisesta oireisten potilaiden pienellä osuudella, pienen otannan, vääristä TSH-tavoitearvoista, muunnon tehok-kuusvaihtelun aiheuttamasta sekoittavasta tekijästä, hoitovasteen laajasta vaihtelusta ja elämänlaatuinstrumentin pienestä vaikutuskoosta [34]. Seitsemässä RCT-tutkimuksessa potilailta kysyttiin, mitä tiettyä hoitojaksoa he pitivät parempana: 48% piti parempana T4+T3-hoitoa, 25% piti parempana T4-hoitoa ja 27%:lla ei ollut väliä [1]. Potilaat, jotka satunnaistettiin saamaan T4 + T3-hoitoa, pudottivat 0,5-1,5 kg, kun taas potilaat, jotka satunnaistettiin T4:lle, pudottivat 0,1-0,5 kg. Viimeaikaiset tutkimukset eivät kuitenkaan ole pystyneet vahvistamaan mieltymysten ja kehon painon muutosten välistä suhdetta [35, 36]. Kaikissa hoitosuosituksissa todetaan, että L-T4:n tulisi olla ensisijainen hoito kilpirauhasen vajaatoimintapotilaille [37].
Voisiko olla niin, että tutkimuksia, joissa verrataan L-T4 + L-T3 -yhdistelmähoitoa ja L-T4-monoterapiaa, ei ole kohdistettu oikealle populaatiolle?
Tämä on hyvinkin mahdollista. Tulokset saattavat olla erilaisia, kun sovelletaan erilaisia valintaperusteita. Uudet RCT:t voidaan harkita rajoitettaviksi potilaisiin, joilla on pysyviä oireita ja/tai erityisiä genotyyppejä, kuten Thr92Ala DIO2. Muitakin polymorfismeja pitäisi harkita tutkittaviksi, kuten aivoille spesifin kilpirauhashormoni-kuljettajaproteiinin OATP1C1n SNP:t, jotka on liitetty uupumukseen ja masennukseen, mutta ei neurokognitiiviseen toimintaan eikä T4:n+T3:n pitämiseen parempana [1]. Mielenkiintoista kyllä, tanskalainen RCT löysi kaksi SNP: tä (Thr92Ala DIO2 ja rs17606253 MCT10 -monokarboksylaatti-kuljettajaproteiini 10), jotka liittyvät suosituimpaan hoitoon: T4+T3 -hoito oli mieluisempi 42%:lla, kun molemmat SNP:t puuttuivat, 63% kun toinen oli läsnä, ja 100%, jos molemmat SNP:t olivat läsnä [35].
Ketkä potilaat voivat saada L-T4 + L-T3 -yhdistelmähoidon?
Vuoden 2012 ETA-ohjeissa ehdotetaan, että “L-T4+L-T3-yhdistelmähoitoa voidaan pitää kokeellisena lähestymistapana lääkitystä noudattavilla, L-T4-hoidetuilla kilpirauhasen vajaatoimintapotilailla, joilla on jatkuvia oireita huolimatta viitealueella olevista seerumin TSH-arvoista, jos he ovat aiemmin antaneet tukensa kroonisen sairautensa hoitamiseksi, ja siihen liittyvät autoimmuunisairaudet on suljettu pois. T4+T3-yhdistelmähoitoa ei suositella raskaana oleville naisille eikä potilaille, joilla on sydämen rytmihäiriöitä” [1]. Italialaiset ja brittiläiset kilpirauhaslääkärien yhdistykset ovat hyväk-syneet nämä suositukset, kun taas ATA:lla on neutraalimpi kanta [37]. Edelleen ehdotetaan, että yhdistelmähoito lopetetaan, jos oireet eivät ole vähentyneet kolmen kuukauden kuluttua. Huoli T4+T3-yhdistelmähoidon pitkäaikaisesta turvallisuudesta on edelleen olemassa, mutta Skotlannissa tehdyn 17-vuotisen havainnoivan väestötutkimuksen tulokset, jotka koskevat liotyroniinin (T3) käyttöä, ovat rauhoittavat [38]. Verrattuna potilaisiin, jotka ottavat vain L-T4: tä (n = 33955), potilailla, jotka käyttivät L-T3:ta (joko L-T4:n kanssa tai ilman, n = 400), ei ollut suurentunut sydän- ja verisuonisairauksien, eteisvärinän tai murtumien riski ikäkorjauksen jälkeen. Bisfosfonaatti- tai statiinireseptien lukumäärässä ei ollut eroa, mutta antipsykoottisten lääkkeiden uusien reseptien riski oli lisääntynyt (riskisuhde 2,26, CI 1,64-3,11), suhteessa L-T3-reseptien määrään [38]. Vuonna 2017 ATA:n jäsenten keskuudessa etsittiin tekijöitä, jotka johtaisivat vaihtoehtoisiin hoitomuotoihin T4:llä hoidetuilla kilpirauhasen vajaatoiminnasta kärsivillä potilailla [39]. Erityisesti oireiden esiintyminen (mukautettu todennäköisyys 25,6), mutta myös alhainen seerumin T3, DIO2 -polymorfismi ja potilaan pyyntö (mukautettu todennäköisyys 2,3-2,6) lisäsi lääkärin halukkuutta määrätä T3:a sisältävää terapiaa, kun taas korkeampi ikä ja muut sairaudet heikensivät halukkuutta. Kilpirauhasen puuttumisella, sukupuolella ja painoindeksillä ei ollut vaikutusta. Yhdistelmähoidon kysyntä lisääntyy Yhdysvalloissa, Kanadassa, Australiassa ja useimmissa Euroopan maissa [40, 41]. Tätä kuvaa hyvin T4+T3-hoidon korvaushakemusten jyrkkä 3,8-kertainen kasvu Tanskassa heinäkuun 2012 – kesäkuun 2013 ja heinäkuun 2013 – kesäkuun 2014 välisenä aikana (kuva 1) [41]. Tämä valtava kasvu johtui todennäköisesti kilpirauhasen vajaatoiminnan ja sen hoidon saamasta laajasta julkisuudesta tiedotusvälineissä. Näyttää siltä, että T4+T3-asiasta on tullut todellinen “hype”. Tanskalaisessa julkaisussa on myös paljon tietoa siitä, mitä tosielämässä tapahtuu yhdistelmähoidon suhteen (taulukko 2) [41]. Tietysti vuoden 2012 ETA-ohjeita ei noudateta monissa tapauksissa. Ohjeissahan suositellaan reseptien määräämistä ja annoksen muuttamista valtuutettujen sisätautilääkäreiden tai endokrinologien toimesta, ei yleislääkärien eikä lainkaan potilaiden itsensä toimesta. Huolestuttavaa on niiden potilaiden suuri osuus, joiden seerumin TSH:n ollessa diagnoosin aikaan <10 mU/l, mikä tarkoittaa, että heillä oli subkliininen kilpirauhasen vajaatoiminta, mikä voi johtaa hoidon hyödyn vähenemiseen ja mahdollisesti ylihoitoon [7, 8, 42].
Mikä on sopiva annos L-T4 + L-T3-yhdistelmähoidossa?
L-T4+L-T3 -yhdistelmähoidon suositeltu annos vuoden 2012 ETA-ohjeissa perustuu siihen olettamaan, että eutyreoosi voidaan saavuttaa samanaikaisesti kaikissa kilpirauhasen vajaatoimintapotilaiden kudoksissa vain LT4+L-T3-annossuhteella, joka jäljittelee ihmisen kilpirauhasen fysiologista T4:n ja T3:n erityssuhdetta (joka on lähellä painosuhdetta 13: 1) [1]. Morreale de Escobarin ym. kokeellisista eläintutkimuksista johdettu olettama voi olla tai ei olla totta. L-T4: n ja L-T3: n farmakodynaaminen vastaavuus on arvioitu satunnaistetussa,
Kuva 1 L-T4 + L-T3-yhdistelmähoidon korvaushakemusten määrä Tanskassa kasvoi 3,8-kertaisesti ajalla heinäkuu 2013 – kesäkuu 2014 verrattuna aikaan heinäkuu 2012-kesäkuu 2013, todennäköisesti voimakkaan kilpirauhasen vajaatoiminnan ja sen hoidon mediajulkisuuden aiheuttamana [ 41 ]
kaksoissokkoutetussa, ristikkäistutkimuksessa 10:llä potilaalla, joilta on poistettu kilpirauhanen [43]. Tavoite (TSH ≥ 0,5 mU/l, mutta enintään 1,5 mU/l vähintään 30 päivän ajan) saavutettiin keskimääräisellä päiväannoksella, joka oli joko 115 ± 38,5 μg L-T4 tai 40 ± 11 μ.g L-T3 (L-T4:n ja L-T3:n suhde 0,36 ± 0,06). Pääteltiin, että L-T4:n terapeuttinen korvaaminen L-T3:lla saavutettiin suhteessa noin 3:1. Toisin sanoen 30 μg T4 voidaan korvata 10 μg:lla T3 ilman muutoksia seerumin TSH:ssa. Siten yksinkertainen menetelmä halutun annossuhteen saavuttamiseksi L-T4:n ja L-T3:n välillä on seuraava. Annos x on päivittäinen L-T4-annos, μg, joka on johtanut normaaliin seerumin TSH-arvoon. Tarvittava päivittäinen L-T3-annos μg (nimeltään y) saadaan muodossa y = x: 20. Pyydetty päivittäinen L-T4-annos, μg (nimeltään z), saadaan muodossa z = x − 3y (taulukko 3) [1]. L-T4 voidaan antaa kerran päivässä, mutta päivittäinen L-T3-annos tulisi jakaa kahteen annokseen, yksi ennen aamiaista ja suurin ennen nukahtamista [1]. Perustelut päivittäisen L-T3-annoksen jakamiselle kahteen (tai jopa kolmeen) annokseen ovat L-T3:n suhteellisen lyhyt puoliintumisaika, seerumin huippupitoisuuden T3-arvot 2-4 tuntia lääkkeenoton jälkeen ja seerumin T3:n fysiologinen vuorokausivaihtelu, jonka huippuarvo on noin kello 4 ja alin arvo noin klo 15–17 [44]. T4+T3-yhdistelmähoito ehdotetaan aloitettavaksi L-T4 L-T3-annossuhteella välillä 13: 1 – 20: 1 [1].
Taulukko 2 “tosielämän” tiedot T4+T3-yhdistelmähoidosta Tanskassa Internet-pohjaisen kyselytutkimuksen [ 41 ]mukaan
| Vastaajat | n = 293 nainen 94%, mies 6%; <40 vuotta 20%, 41-60 vuotta 63%, ≥ 61 vuotta 17%; 1 ° / 2 ° koulutus
11%, ammatillinen tai lyhyt 3 ° koulutus 28%, 3 ° koulutus > 3 v. 60%, ei vastausta 1% |
| Kilpirauhasen vajaatoiminnan kesto | <1 vuotta 4%, 1-3 vuotta 15%, 3-10 vuotta 36%,> 10 vuotta 45% |
| TSH diagnosointihetkellä | En muista 26%; <4 mU/l 26%; 4-10 mU/l 18%; 10-20 mU/l 11%; 20-50 mU/l 6%; > 50 mU/l 12% |
| Oireet ennen T4+T3-hoidon aloittamista | Väsymys 91%, energian puute 87%, kognitiiviset ongelmat 83%, tuki- ja liikuntaelinten oireet 76%, paino-ongelmat 75%, kipu 49%, ummetus 42%, masennus 39% |
| Reseptit | L-T4+L-T3-hoito 43%, kuivattu kilpirauhasuute 50%, muu lääke 7%, sekä L-T3 että kuivattu 1% |
| Annosmuutokset | Lääkäri (verinäytteet) 44%, lääkäri (oireet) 17%, minä (oireet) 28%, ei vastausta (11%) |
| T4 + T3-hoidon kesto | 3-6 kuukautta 56%, 6-12 kuukautta 16%, 1-3 vuotta 14%,> 3 vuotta 10%, ei vastausta 4% |
| Viimeisin TSH | <0,01 mU/l 14%, 0,01-1,0 mU/l 54%, 1,0-2,5 mU/l 14%, 2,5-4,0 mU/l 8%,> 4,0 mU/l 5%, ei vastausta 4% |
| Vaste T4 + T3 -hoitoon | Ihmeellinen 19%, paljon parempi 43%, parempi 22%, ei eroa 6%, huonompi 2%, ei vastausta 8% |
Taulukko 3 Yksinkertainen menetelmä sopivien L-T4- ja L-T3-annosten laskemiseksi T4 + T3-yhdistelmähoidolla [1]
| T4-monoterapian x = L-T4 -annos, joka normalisoi TSH: n | 100 μg L-T4 = annos x | 150 μg L-T4 = annos x | 200 μ g L-T4 = annos x | |
| T4 (annos z) + T3 (annos y) yhdistelmähoito
L-T3-annos y = x: 20 L-T4-annos z = x−3y L-T4-annos (pyöristetty) L-T4: L-T3-annossuhde |
5 μg
85 μg 87.5 μg 17:1 |
7.5 μg
127.5 μg 125 μg 17:1 |
10 μg
170 μg 175 μg 17: 1 |
|
|
Taulukko 4 Saatavana olevat versiot L-T3-tableteista, L-T3 + L-T4 -yhdistelmätableteista ja kuivatetusta kilpirauhasuutteesta [ 44 ] |
||||
| Kauppanimi | T3-annos | T4-annos | Saatavuus | |
| L-T3-tabletit
Cytomel |
5, 25, 50 μg | USA, Kanada, Hollanti | ||
| Thybon | 20, 100 μg | Yhdistynyt kuningaskunta | ||
| Tertroxin | 20 μg | Australia ja Etelä-Afrikka | ||
| Liotyr | 5 μg (pehmeä geeli) | Italia | ||
| L-T3 + L-T4 -tabletit
Prothyroid |
10 μg | 100 μg | Saksa | |
| Novothyral | 5, 15, 20 μg | 25, 75, 100 μg | Eurooppa | |
| Thyreotom forte | 10, 30 μg | 40, 120 μg | Tšekin tasavalta | |
| Kuivattu kilpirauhasuute Nature throid 65 mg eli grainia kohti | 9 μg | 38 μg | Yhdysvallat | |
| Westhroid puhdas 65 mg eli grainia kohti | 9 μg | 38 μg | Yhdysvallat | |
| NP thyroid 60 mg eli grainia kohti | 9 μg | 38 μg | Yhdysvallat | |
| Thyroid (Erfa) 60 mg grainia kohti | 8 μg | 35 μg | Eurooppa, Kanada | |
| Armour thyroid 60 mg grainia kohti | 9 μg | 38 μg | Yhdysvallat | |
Seerumin T3-V/T4-V-suhde (pmol/l – pmol/l) kilpirauhasen vajaatoimintapotilailla, jotka saavat L-T4-korvaushoitoa, on 0,24 (IQR 0,20-0,28), joka on alempi kuin terveiden verrokkien arvo 0,32 (IQR 0,27-0,37) [16]. RCT:ssä seerumin T3-V/T4-V-suhde on 0,30 (IQR 0,25-0,45) L-T4 + L-T3-yhdistelmähoidon aikana, korkeampi kuin arvo 0,24 (IQR 0,18-0,25) L-T4-monoterapian aikana, mutta silti jonkin verran alhaisempi kuin verrokeilla [1]. Tanskalaisessa retrospektiivisessa havainnointitutkimuksessa raportoidaan potilaista, joilla on pysyviä oireita huolimatta L-T4-hoidosta ja normaalista seerumin TSH-arvosta [45]. Hoito muutettiin L-T4 + L-T3-yhdistelmähoidoksi suhteessa 17:1 (paino / paino). 12 kuukauden jälkeen 65% sai avun ja 35% ei saanut apua. Ryhmien välillä ei ollut eroja seerumin T4:n vähenemisessä (vastaavasti-18 ja -4,5 nmol/l) eikä seerumin T3: n nousussa (vastaavasti+0,28 ja +0,25 nmol/l).
Mitä valmisteita voidaan käyttää L-T4 + LT3-yhdistelmähoidossa ja miten niiden käyttöä tulisi seurata?
Vuoden 2012 ETA-ohjeissa suositellaan erillisten L-T4- ja L-T3-tablettien käyttöä yhdistelmähoidossa, koska saatavissa olevien yhdistelmätablettien annossuhteet L-T4 / L-T3 ovat 4:1, 5:1 ja 10:1 (taulukko 4). Nämä suhteet ovat merkitsevästi erilaisia kuin suositellut suhteet 13:1 – 20:1. Jos annoksen säätäminen on tarpeen, on myös kätevämpää muuttaa vain yhden komponentin, mieluummin L-T3:n, annosta [1]. L-T3:n farmakokinetiikan kannalta L-T3:n hitaasti vapauttava valmiste olisi tervetullut, mutta sitä ei ole toteutettu. Thyromaxin, L-T3-tabletin, jonka lisäaineena on mikrokiteinen selluloosa ja magnesiumstearaatti, toivottiin vapauttavan T3:a hitaasti, mutta sen seerumin T3-profiili on samanlainen kuin Cytomelin [ 46 , 47 ]. Yksi annos T3-sulfaattia tuotti vakaan seerumin T3-pitoisuuden 48 tunnin ajaksi, mutta tästä mielenkiintoisesta havainnosta ei ole enää kuulunut mitään [48]. Vuodesta 2012 lähtien on kuitenkin markkinoille tullut matalan pitoisuuden L-T3-tabletteja (kuten 5 μg Cytomelia). Tablettien jakaminen puoliksi on hyödyllistä, jos vaaditaan pieniä annoksia, 2,5 tai 7,5 μg L-T3. Tämän kehityksen taustalla on epäilemättä suuri kiinnostus yhdistelmähoitoon. Tämän kehityksen kielteisenä puolena on pantava merkille tiettyjen lääkeyhtiöiden toteuttama L-T3 -tablettien hintojen nousu, jota ei voida hyväksyä. Esimerkiksi Isossa-Britanniassa yhden 20 μg:n geneerisen L-T3-tabletin hinta nousi yhtäkkiä 0,16:sta 9,22 puntaan. Englannin julkisen terveydenhuollon L-T3-reseptien kokonaiskustannukset olivat 758 975 puntaa elokuussa 2013; määrä nousi melkein kymmenkertaiseksi 7 018 679 puntaan heinäkuuhun 2018 mennessä huolimatta pienemmästä lääkemääräysten määrästä [49]. Tämä kaikki johti laajalle levinneeseen potilaiden huoleen, julkisuuteen tiedotusvälineissä ja aloitteeseen parlamentin ylähuoneessa. Lordi Huntin (Kings Heath) tekemä aloite kuuluu: “Ylähuone pahoittelee, että vuoden 2018 lääketieteellistä lääkehuoltoa (kustannuksia) koskevat säädökset eivät ehdota mitään toimenpiteitä Concordian ja muiden yritysten perimien korkeiden Liothyroninin hintojen suhteen kilpirauhasen vajaatoiminnan hoitamiseksi, jolloin potilaita estetään näin saamasta tätä välttämätöntä lääkettä” [50]. Lopuksi potilaat pitivät kuivattua kilpirauhasuutetta, DTE:tä, parempana verrattuna L-T4: ään RCT:ssä [51] ja verkkosivustopohjaisessa kyselytutkimuksessa [5]. DTE:tä ei suositella hoitosuosituksissa, mutta potilaiden parempana pitämää lääkettä tulisi tutkia perusteellisemmin.
Taulukko 5 Vuoden 2012 ETA-suosituksissa esitetyt, tulevia tutkimuksia koskevat ehdotukset L-T4 + L-T3:n käytöstä kilpirauhasen vajaatoiminnan hoidossa [ 1 ]
- Etenevät tutkimukset kilpirauhasen vajaatoimintapotilailla, jotka aloittavat L-T4-hoidon, joissa verrataan lähtötilanteen arvoja niiden välillä, jotka tulevat ja eivät tule saamaan apua LT4-monoterapiasta.
- Kokeet, joissa tutkitaan L-T4 / L-T3 -annossuhdetta, joka parhaiten vastaa seerumin FT4 / FT3-pitoisuussuhdetta terveillä koehenkilöillä.
- Satunnaistetut kliiniset tutkimukset, joissa verrataan L-T4 + L-T3-yhdistelmähoitoa ja L-T4-monoterapiaa kilpirauhasen vajaatoimintapotilailla, joilla on pysyviä oireita ja / tai jotka kantavat polymorfismeja kilpirauhashormonin kuljettajaproteiineissa ja dejodinaaseissa.
- Tutkimukset hitaasti vapautuvalla L-T3-valmisteella.
- Etenevät tutkimukset, joissa arvioidaan L-T4 + L-T3 -yhdistelmähoidon pitkäaikaista tehokkuutta ja turvallisuutta.
Mikään näistä ehdotuksista ei ole toteutunut seitsemän vuotta myöhemmin, kesäkuussa 2019
Mitkä ovat tämän aiheen tulevaisuuden tutkimusalueet?
Sen jälkeen, kun ETA:n hoitosuositus julkaistiin vuonna 2012, monet T4 + T3-yhdistelmähoitoa koskevat kysymykset ovat selventyneet. Tyypin 2 dejodinaasin SNP:ien (kuten Thr92Ala) oletetun roolin selvittämisessä on tapahtunut paljon edistystä, mutta vielä on epäselvää, miksi jotkut L-T4-potilaat kokevat pysyviä oireita normaalista seerumin TSH:sta huolimatta. Yhdistelmähoidon kiistanalainen rooli voidaan mielestäni ratkaista vain tekemällä paljon enemmän kliinisiä tutkimuksia. On vakava asia, että toistaiseksi yhtäkään vuoden 2012 hoitosuosituksessa ehdotetuista tutkimuksista ei ole toteutettu (Taulukko 5). Tämä on vielä huolestuttavampaa siksi, että tyytymättömyys hoidon tuloksiin kasvaa, ja kliininen ongelma on nyt saanut poliittisia sävyjä. Kliinisestä tutkimuksesta tulee hankalampaa, kun mukana on politiikka.
Eettisten normien noudattaminen
Eturistiriidat Kirjoittaja ilmoittaa, ettei hänellä ole mitään eturistiriitaa.
Eettinen hyväksyntä Tämä artikkeli ei sisällä kirjoittajan suorittamia tutkimuksia ihmisillä.
Tietoinen suostumus Tämä artikkeli on katsaus kirjallisuudessa julkaistuihin artikkeleihin. Katso alkuperäiset artikkelit, jos haluat tietoja osallistujien tietoisesta suostumuksesta aikaisempiin tutkimuksiin.
Kustantajan huomautus: Springer Nature on edelleen puolueeton julkaistuissa kartoissa esitettyjen lainkäyttövaltuuksien ja institutionaalisten yhteyksien suhteen.
Avoin saatavuus Tämä artikkeli on jaettu Creative Commons Attribution 4.0 -lisenssin kansainvälisellä lisenssillä ( http: // creativecommons.org/licenses/by/4.0/ ), joka sallii rajoittamattoman käytön, jakelun ja jäljentämisen mihin tahansa mediaan, mikäli annat asianmukaisen hyvityksen alkuperäiselle tekijälle ja lähteelle, jos annat linkin Creative Commons-lisenssiin ja ilmoitat, onko muutoksia tehty.
Lähteet
- WM Wiersinga, L. Duntas, V. Fadeyev, B. Nygaard, MP Vanderpump, 2012 ETA guidelines: the use of L-T4+L-T3 in the treatment of hypothyroidism. Eur. Thyroid J. 1, 55–71 (2012)
- P. Saravanan, W.-F. Chau, N. Roberts, K. Vedhara, R. Greenwood, C.M. Dayan, Psychological well-being in patients on ‘adequate’ doses of L-thyroxine: results of a large, controlled community-based questionnaire study. Clin. Endocrinol. 57,577-585 (2002)
- E.M. Wekking, B.C. Appelhof, E. Fliers, A.H. Schene, T. Huyser,J.G.P. Tijssen, W.M. Wiersinga, Cognitive functioning and wellbeing in euthyroid patients on thyroxine replacement therapy for primary hypothyroidism. Eur. J. Endocrinol. 153, 747-753 (2005)
- V. Panicker, J. Evans, T. Bjoro, B.O. Asvold, C.M. Dayan, O. Bjerkeset, A paradoxical difference in relationship between anxiety, depression and thyroid function in subjects on and not on T4: findings from the HUNT study. Clin. Endocrinol. 71, 574-580 (2009)
- SJ Peterson, AR Cappola, MR Castro, CM Dayan, APFarwell, JV Hennessey et ai. An online survey of hypothyroid patients demonstrates prominent dissatisfaction. Kilpirauhanen 28, 707-721 (2018)
- P.N. Taylor, A. Iqbal, C. Minassian, A. Sayers, M.S. Draman, R.Greenwood et al. Falling threshold for treatment of borderline elevated thyrotropin levels—balancing benefits and risks: evidence from a large community-based study. JAMA Intern. Med. 174, 32-39 (2014)
- D.J. Stott, N. Rodondi, P.,M. Kearney, I. Ford, R.G.J. Westendorp, S.P. Mooijaart et al. Thyroid hormone therapy for older adults with subclinical hypothyroidism. N. Engl. J. Med. 376, 2534-2544 (2017)
- M. Feller, M. Snel, E. Moutzouri, D.C. Bauer, M. de Montmollin,D. Aujesky et al. Association of thyroid hormone therapy with quality of life and thyroid-related symptoms in patients with subclinical hypothyroidism: a systematic review and metaanalysis. JAMA 320, 1349-1359 (2018)
- R.P. Peeters, Subclinical hypothyroidism. N. Engl. J. Med. 376, 2556-25655 (2017)
- R. Dew, K. King, O.E. Okosieme, S. Pearce, G. Donovan, P.N.Taylor et al. towards treatment of hypothyroidism in general practice: an in-depth qualitative interview study. BJGP Open 1, bjgopen17X100977 (2017). https://doi.org/10.3399/bjgopen17X10097
- R. Dew, K. King, O.E. Okosieme, S.H. Pearce, G. Donovan, P.N.Taylor et al. Attitudes and perceptions of health professionals towards management of hypothyroidism in general practice: a qualitative interview study. BMJ Open 8, e019970 (2018). https: // doi.org/10.1136/bmjopen-2017-019970
- K. Boelaert, PR Newby, MJ Simmonds, RL Holder, JD CarrSmith, JM Heward et al. Prevalence and relative risk of other autoimmune diseases in subjects with autoimmune thyroid disease. Am. J. Med. 123, 183.e1-183.e9 (2010)
- I. Guldvog, L.C. Reitsma, L. Johnsen, A. Lauzike, C. Gibbs, E.Carlsen et al. Thyroidectomy versus medical management for euthyroid patients with Hashimoto disease and persisting symptoms. A randomized trial. Ann. Int. Med. (2019). https://doi.org/ 10.7326 / M18-0284 Med. (2019). https://doi.org/ 10.7326 / M18-0284
- S.J. Peterson, E.A. McAninch, A.C. Bianco, Is a normal TSH synonymous with “euthyroidism” in levothyroxine monotherapy? J. Clin. Endocrinol. Metab. 101, 4694-4973 (2016)
- D. Gullo, A. Latina, F. Frasca, R. LeMoli, G. Pellegritti, R. Vigneriet al. Levothyroxine monotherapy cannot guarantee euthyroidism in all athyreotic patients. PLOS ONE 6, e22552 (2011)
- J.P. Walsh, L.C. Ward, V. Burke, C.I. Bhagat, L. Shiels, D.Henley et al. Small changes in thyroxine dosage do not produce measurable changes in hypothyroid symptoms, wellbeing, or quality-in-life: results of a double-blind, randomized clinical trial. J. Clin. Endocrinol. Metab. 91, 2624-2630 (2006)
- M.H. Samuels, I. Kollobova, M. Niederhausen, J.S. Janowsky, K.G. Schuff, Effects of altering levothyroxine (L-T4) doses on quality of life, mood, and cognition in L-T4 treated subjects. J. Clin. Endocrinol. Metab. 103, 1997-2008 (2018)
- M.H. Samuels, I. Kolobova, M. Niederhausen, J.Q. Purnell, K.G. Schuff, Effects of altering levothyroxine dose on energy expenditure and body composition in subjects treated with LT4. J. Clin. Endocrinol. Metab. 103, 4163-4175 (2018)
- M. Ito, A. Miyauchi, S. Morita, T. Kudo, E. Nishihara, M. Kihara et al. TSH-suppressive doses of levothyroxine are required to achieve preoperative native serum triiodothyronine levels in patients who have undergone total thyroidectomy. Eur. J. Endocrinol. 167, 373-378 (2012)
- D. Strich, C. Chay, G. Karavani, S. Edri, D. Gillis, Levothyroxine therapy achieves physiological FT3/FT4 ratios at higher than normal TSH levels: a novel justification for T3 supplementation? Horm. Metab. Res. 50, 827-831 (2018)
- B. Gereben, E.A. McAninch, M.O. Ribeiro, A.C. Bianco, Scopeand limitations of iodothyronine deiodinases in hypothyroidism. Nat. Rev. Endocrinol. 11, 642-652 (2015)
- J.P. Werneck de Castro, T.L. Fonseca, C.B. Ueta, E.A. McAninch,S. Abdalla, G. Wittmann et al. Differences in hypothalamic type 2 deiodinase ubiquitination explain localized sensitivity to thyroxine. J. Clin. Investig. 125, 769-781 (2015)
- M. Ito, A. Miyauchi, M. Hisakado, W. Yoshioka, A. Ide, T. Kudo et al. Biochemical markers reflecting thyroid function in athyreotic patients on levothyroxine monotherapy. Thyroid 27, 484–490 (2017)
- E.A. McAninch, K.B. Rajan, C.H. Miller, A.C. Bianco, Systemic thyroid hormone status during levothyroxine therapy in hypothyroidism: a systematic review and meta-analysis. J. Clin. Endocrinol. Metab. 103, 4533-4542 (2018)
- R. Hoermann, J.E. Midgley, R. Larisch, J.W. Dietrich, Is pituitary TSH an adequate measure of thyroid hormone-controlled homeostasis during thyroxine treatment? Eur. J. Endocrinol. 168, 271-280 (2013)
- V. Panicker, P. Saravanan, B. Vaidya, J. Evans, A.T. Hattersley,T.M. Frayling, C.M. Dayan, Common variation in the DIO2 gene predicts baseline psychological well-being and response to combination thyroxine plus triiodothyronine therapy in hypothyroid patients. J. Clin. Endocrinol. Metab. 94, 1623-1629 (2009)
- M.G. Castagna, M. Dentice, S. Cantara, R. Ambrosio, F. Maino,T. Porcelli et al. DIO2 Thr92Ala reduces deiodinase-2 activity and serum-T3 levels in thyroid-deficient patients. J. Clin. Endocrinol. Metab. 102, 1623-1630 (2017)
- M. Medici, L. Chaker, R.P. Peeters, A step forward in understanding the relevance of genetic variation in type 2 deiodinase. J. Clin. Endocrinol. Metab. 102, 1775-1778 (2017)
- H.J.C.M. Wouters, H.C.M. van Loon, M.M. van der Klauw, M.F. Elderson, S.N. Slagter, A. Muller Kobold et al. No effect of the Thr92Ala polymorphism of deiodinase-2 on thyroid hormone parameters, health-related quality of life, and cognitive functioning in a large population-based cohort study. Thyroid 27, 147–155 (2017)
- E.A. McAninch, S. Jo, N.Z. Preite, E. Farkas, P. Mohacsik, C.Fekete et al. Prevalent polymorphism in thyroid hormone-activating enzyme leaves a genetic fingerprint that underlies associated clinical syndromes. J. Clin. Endocrinol. Metab. 100, 920-933 (2015)
- S. Jo, T.L. Fonseca, B.M.L.C. Bocco, G.W. Fernandes, E.A.McAninch, A.P. Bolin et al. Type 2 deiodinase polymorphism causes ER stress and hypothyroidism in the brain. J. Clin. Investig. 129, 230-245 (2019)
- H.B. Burch, K.D. Burman, D.S. Cooper, J.V. Hennessey, A2013 survey of clinical practice patterns in the management of primary hypothyroidism. J. Clin. Endocrinol. Metab. 99, 2077-2085 (2014)
- J. Kaminski, F.Y. Miasaki, G. Paz-Filho, H. Graf, G.A. de Carvalho, Treatment of hypothyroidism with levothyroxine plus liothyronine: a randomized, double-blind, crossover study. Arch. Endocrinol. Metab. 60, 562-572 (2016)
- R. Hoermann, J.E.M. Midgley, R. Larisch, J.W. Dietrich, Lessons from randomised clinical trials for triiodothyronine treatment of hypothyroidism: have they achieved their objectives? J. Thyroid Res. (2018). https://doi.org/10.1155/2018/3239197
- A. Carlé, J. Faber, R. Steffensen, P. Laurberg, B. Nygaard,Hypothyroid patients encoding combined MCT10 and DIO2 gene polymorphisms may prefer L-T3+L-T4 combination treatment data using a blind, randomized clinical study. Eur. Thyroid J. 6, 143–151 (2017)
- L.F. Michaelsson, J.L. la Cour, B.B. Medici, T. Watt, J. Faber, B.Nygaard, Levothyroxine/liothyronine combination therapy and quality of life: is it all about weight loss? Eur. Thyroid J. 7, 243–250 (2018)
- J.V. Hennessey, R. Espaillat, Current evidence for the treatment of hypothyroidism with levothyroxine/levotriiodothyronine combination therapy versus levothyroxine monotherapy. Int. J. Clin. Pract. 72, e13062 (2018)
- G.P. Leese, E. Soto-Pedre, L.A. Donnelly, Liothyronine use in a17 year observational population-based study – the TEARS study. Clin. Endocrinol. 85, 918-925 (2016)
- J. Jonklaas, E. Tefera, N. Shara, Physician choice of hypothyroidism therapy: influence of patient characteristics. Thyroid 28, 1416–1424 (2018)
- J. Jonklaas, E. Tefera, N. Shara, Physician choice of hypothyroidism therapy: influence of patient characteristics. Thyroid 29, 44–52 (2019)
- L.F. Michaelsson, B.B. Medici, J.L. la Cour, C. Selmer, M. Roder,H. Perrild et al. Treating hypothyroidism with thyroxine/triiodothyronine combination therapy in Denmark: following guidelines or following trends?. Eur. Thyroid J. 4, 174–180 (2015)
- B.B. Medici, B. Nygaard, J.L. la Cour, M.K. Grand, V. Siersma,D.R. Nicolaisdottir et al. Changes in prescription routines for treating hypothyroidism between 2001 and 2015 – an observational study of 929,684 primary care patients in Copenhagen. Thyroid 29 (2019). https://doi.org/10.1089/thy.2018.0539
- F.S. Celi, M. Zemskova, J.D. Linderman, N.I. Babar, M.C.Skarulis, W. Csako et al. The pharmacodynamics equivalence of levothyroxine and liothyronine: a randomized, double blind, cross-over study in thyroidectomized patients. Clin. Endocrinol. 72, 709-715 (2010)
- C. Dayan, V. Panicker, Management of hypothyroidism with combination thyroxine (T4) and triiodothyronine (T3) hormone replacement in clinical practice: a review of suggested guidance. Thyroid Res. 11 (2018). https://doi.org/10.1186/s13044-018-0045-x
- B.B. Medici, J.L. la Cour, L.F. Michaelsson, J.O. Faber, B. Nygaard. Neither baseline nor changes in serum triiodothyronine during levothyroxine/liothyronine combination therapy predict a positive response to this treatment modality in hypothyroid patients with persistent symptoms. Eur. Thyroid J. 6, 89–93 (2017)
- J. Jonklaas, K.D. Burman, H. Wang, K. Latham, Single dose T3 administration: kinetics and effects on biochemical and physiologic parameters. Ther. Drug Monit. 37, 110-118 (2015)
- J. Jonklaas, K.D. Burman, Daily administration of short-acting liothyronine is associated with significant triiodothyronine excursions and fails to alter thyroid-responsive parameters. Thyroid 26, 770–778 (2016)
- F. Santini, M. Giannetti, I. Ricco, G. Querci, G. Saponati, D.Bokor et al. Steady-state serum T3 concentrations for 48 h following the oral administration of a single dose of 3,5,3’-triiodothyronine sulfate (T3S). Endocr. Pract. 20, 680-689 (2014)
- P.N. Taylor, S. Razvi, I. Muller, J. Wass, C.M. Dayan, K. Chatterjee, K. Boelaert, Liothyronine cost and prescriptions in England. Lancet Diab Endocrinol. 7, 11-12 (2019)
- https://hansard.parliament.uk/Lords/2018-06-20/debates/5A689F14-D2F8-4796-8732-CBD0E3B3E508/BrandedHealthServiceMedicines(Costs)Regulations2018
- T.D. Hoang, C.H. Olsen, V.Q. Mai, P.W. Clyde, M.K. Shakir,desiccated thyroid extract compared with levothyroxine in the treatment of hypothyroidism: a randomized, double-blind, crossover study. J. Clin. Endocrinol. Metab. 98, 1982-1990 (2013)
Emeritusprofessori Wiersingasta:
https://www.emedevents.com/speaker-profile/wilmar-m-wiersinga
Tämä käännös on tarjottu Suomen kilpirauhaspotilaat ry:lle. Se ei heille kelvannut.
Tutkimuksia kilpirauhaslääkkeistä
Suomalaiset endokrinologit ovat sitä mieltä, että muuta kilpirauhasen vajaatoiminnan hoitoa kuin T4-monoterapia ei ole tutkittu, eikä tutkitakaan.
Suomalaisia endokrinologeja ei ole juurikaan näkynyt puhujina kansainvälisissä endokrinologien tapaamisissa.
Itse asiassa T4-monoterapiaa ei ole tutkittu lainkaan endokrinologien vaatimilla kriteereillä.
https://hypotyreoosi.wordpress.com/2014/11/24/t4-monoterapian-tieteellinen-perusta-osa-2/
Päättyneitä tutkimuksia:
T3-monoterapia todettiin täysin turvalliseksi tutkimuksissa:
T3:a käyttäneitä seurattiin 20 vuoden ajan Skotlannissa, eikä löydetty mitään vakavia terveysvaikutuksia! http://www.endocrine-abstracts.org/ea/0038/ea0038OC5.6.htm
Tanskalainen tutkimusryhmä tutki synteettistä yhdistelmää, ja julkaisi yhdistelmälle myönteisen raporttinsa vuonna 2009
Käynnissä olevia tutkimuksia:
Saksalainen suuri kokonaisuus, valmista odotetaan vuonna 2018. Ilmeisesti projektissa kehitetään myös uusia kilpirauhaslääkkeitä. Perusteluissa mainitaan, ettei tyroksiini yksinään riitä suurelle osalle potilaista.
http://www.thyroidtransact.de/
Yhdysvaltain puolustusvoimien vertaileva tutkimus T4, T4 + T3 ja eläinperäinen kilpirauhasuute, valmistunee vuonna 2018. Pilotti julkaistiin vuonna 2013, ja siinä puolet koehenkilöistä piti eläinperäistä kilpirauhasuutetta parempana kuin tyroksiinia.
https://clinicaltrials.gov/ct2/show/NCT02317926
Yhdysvaltalainen lääkintätutkimus subkliinistä vajaatoimintaa sairastavilla vanhuksilla, mukana myös T3-monoterapia. Valmistunee vuonna 2019.
https://clinicaltrials.gov/ct2/show/NCT02399475
Yhdysvaltalainen tutkimus yhdistelmälääkityksen T4 + T3 vaikutuksesta eri biomarkkereihin. Valmistunee 2019-2020. https://clinicaltrials.gov/ct2/show/NCT03053115
(Aiemmin näitä on tutkinut tanskalainen tutkimusryhmä ylilääkäri Nygaardin johdolla: https://hypotyreoosi.wordpress.com/2014/10/17/tanskalaisia-tutkimuksia-yhdistelmaterapiasta-osa-3/ )
Vaikuttaako ruokavalio autoimmuuniprosessiin?
Italialaiset ja ranskalaiset tutkijat lähtivät etsimään vastausta, ja julkaisivat viime vuonna tämän tutkimuksen:
Effects of low-carbohydrate diet therapy in overweight subject with autoimmune thyroiditis: possible synergism with ChREBP
Vähähiilihydraattisen ruokavalion vaikutus ylipainoisiin autoimmuunityreoidiittia (Hashimoton tautia) sairastaviin potilaisiin
Tutkimuksessa oli mukana 180 henkilöä, 84 miestä ja 96 naista, iältään 30-45 vuotta. Kaikilla oli kilpirauhasvasta-aineita yli viitteen. Tutkimusjoukosta suljettiin pois naiset, joilla oli jo vaihdevuodet alkaneet, tai jotka olivat äskettäin käyttäneet hormonaalista ehkäisyä. Tutkittavat jaettiin vhh-ruokavalioryhmään ja verrokkiryhmään. Tutkimus kesti kolme viikkoa. Tutkijat seurasivat vhh-ryhmän ja verrokkiryhmän kilpirauhashormoneja (T3-V, T4-V ja TSH), kilpirauhasen vasta-aineita, painoa ja painoindeksiä.
Tutkitut vasta-aineet, joista tässä puhutaan, ovat kilpirauhasen mikrosomaaliset vasta-aineet, TPOab ja TyglAb, jotka selostetaan englanniksi tässä:
https://en.wikipedia.org/wiki/Anti-thyroid_autoantibodies
Joukosta muodostettiin tutkimusryhmäksi 108 potilasta, 44 miestä ja 64 naista, joka noudatti seuraavanlaista ruokavaliota: 12-15 energia-% hiilihydraatteja, 50-60 % proteiinia, ja 25 – 30 % rasvaa (toim. huom. tämä ei ole vhh- vaan runsasproteiininen dieetti). Heitä neuvottiin syömään lehti- ja muita vihanneksia, vähärasvaista lihaa ja välttämään goitrogeeneja (kilpirauhasen toimintaa haittaavia vihanneksia kuten ristikukkaiset kaalikasvit, hirssi, soijatuotteet, persikka, nektariini jne.). Seuraavat ruoka-aineet poistettiin kokonaan: munat, palkokasvit, maitotuotteet, leivät, pasta, hedelmät ja riisi. Ryhmä noudatti tätä proteiinirikasta ruokavaliota kolmen viikon ajan, jonka jälkeen tehtiin bioimpedanssimittaukset, punnitukset ja verikokeet (kilpirauhasen vasta-aineet ja hormonit).
Verrokkiryhmä, 72 henkeä, joista 40 miestä ja 32 naista, noudatti kolmen viikon ajan ravintosuositusten mukaista vähäkalorista ruokavaliota. Koeajan loputtua heille tehtiin samat kokeet kuin tutkimusryhmälle.
Tulos:
Verrokkiryhmän vasta-aineiden määrä lisääntyi suositellulla ruokavaliolla
Tutkimusryhmän vasta-aineet putosivat huomattavan paljon jo kolmessa viikossa:
Ruokavalio siis vaikuttaa vasta-aineiden määrään vähentävästi, mikä todennäköisesti vähentää autoimmuunitulehdusta, ja sen mukana kilpirauhasen tuhoutumista.
A dietary plan based on the reduction of carbohydrate content and free of goitrogenic foods leads not only to a decrease in body weight, but also determines a decrease in fat mass and a significant drop of sentinel autoantibodies in Hashimoto’s thyroiditis. — Do not underestimate the value of the levels of anti-microsomal Abs, still not considered relevant in screening for autoimmune thyroiditis, the dietary regime described in this study could be implemented for the treatment of patients with autoimmune thyroid because of the possibility to reduce the inflammation state in general and of the thyroid gland in particular, and consequently of the levels of autoantibodies, information this surely important in the assessment of these patients and for the prediction of the course of the disease.
Tutkijoiden yhteenvedosta: Ruokavalio, joka perustuu hiilihydraattirajoitukseen ja joka ei sisällä goitrogeeneja, johtaa paitsi painon putoamiseen myös rasvamassan vähenemiseen ja kilpirauhasvasta-aineiden vähenemiseen Hashimoton autoimmuunitulehduksessa. — Ei pidä vähätellä mikrosomaalisten vasta-aineiden merkitystä. Niitä ei vielä pidetä asianmukaisina etsittäessä kilpirauhasen autoimmuunitulehdusta. Tässä tutkimuksessa kuvattua ruokavaliota voitaisiin käyttää Hashimoto-potilaille, koska se voi vähentää tulehdusta yleisesti ja kilpirauhasen tulehdusta erityisesti, ja sen seurauksena vasta-ainetasoja. Tämä tieto on tärkeä potilaiden tilan arvioinnissa ja sairauden kulun ennustamisessa.
———–
Ja sitten nämä suomalaiset ”asiantuntijat”. Vain tupakointi voi vaikuttaa sairauden kulkuun:
Tanskalaiset tutkivat geenimuunnoksia
Vaikka Suomen endokrinologiyhdistys mitätöi geenivirheiden aiheuttamat ongelmat kilpirauhasen vajaatoiminnan hoidossa, muualla ollaan niistä kiinnostuneita. Erilaisia geenivirheitä löydetään jatkuvasti lisää.
Myöskään DIO2-geenipolymorfismimäärityksen avulla ei ole mahdollista arvioida höytyisikö potilas Thyroxin-hoidon sijasta trijodityroniinihoidosta (T3-hoito, kauppanimellä Liothyronin ja Thybon).
ThyroidUK on listannut niitä sivustollaan, ja niitä on varmasti löydetty sen jälkeen lisää. Yhdelle geenivirheelle on jo saatavissa kaupallinen testi.
Vasta ilmestyneessä tanskalaistutkimuksessa tutkittiin muutamaa geenimuunnosta ja niiden yhdistelmiä. Tutkimusjoukko koostui 45 selvästi autoimmuunista vajaatoimintapotilaasta. Mukana tutkijoissa oli Euroopan suosituksia valmistellut endokrinologian ylilääkäri Birte Nygaard.
Hypothyroid Patients Encoding Combined MCT10 and DIO2 Gene Polymorphisms May Prefer L-T3 + L-T4 Combination Treatment – Data Using a Blind, Randomized, Clinical Study
Carlé A.a · Faber J.c,d · Steffensen R.b · Laurberg P.a · Nygaard B.c,d
Tutkimusjoukko koostui Hashimoton autoimmuunitulehdusta sairastavista kilpirauhasen vajaatoimintapotilaista, jotka olivat olleet tyroksiinihoidolla 6 kuukautta, ja heidän kilpirauhasarvonsa olivat olleet viitealueella. Kyseessä oli etenevä kaksoissokkotutkimus.
Joukko jaettiin kahtia. Toinen ryhmä jatkoi 3 kk tyroksiinihoidolla, toisella ryhmällä korvattiin 50 µg tyroksiinia 20 µg:lla liotyroniinia (T3). TSH:n säädöt tehtiin tyroksiinilla. 3 kk kuluttua vaihdettiin lääkitystä siten, että tyroksiiniryhmälle annettiin yhdistelmälääkitys ja yhdistelmälääkityille tyroksiinia.
Tutkimuksen aikana seurattiin eri geenimuunnoksia: 3 muunnosta DIO2-geenissä ja yhtä kuljetusproteiinin MCT10 muunnosta. Puolen vuoden tutkimuksen jälkeen kysyttiin potilailta, kumpaa lääkitystä he pitivät parempana.
27/45 (60 %) potilasta piti yhdistelmää parempana.
Tutkijat yhdistivät kaksi geenimuunnosta, DIO2-geenin Thr92Ala (se, jota saa testata yleisesti) ja kuljetusproteiinigeenin MCT10 muunnoksen rs17606253, ja saivat aikaan kolme ryhmää: potilaat joilla ei ollut kumpaakaan, ne joilla oli toinen muunnos ja ne joilla oli molemmat. Näissä ryhmissä yhdistelmää piti parempana 42 %, 63 % ja 100 %.
Johtopäätöksenä tutkijat sanovat, että yhdistelmäterapiaa saatetaan tulevaisuudessa käyttää tiettyjä geenimuunnoksia omaaville potilaille.




