Etusivu » dejodinaasit
Category Archives: dejodinaasit
Testaa muuntosi, ellet voi hyvin tyroksiinilla!
Tiedätkö, että voit testata muuntosi, mikäli sinulla on samaan aikaan otetut TSH, T4-V ja T3-V, sekä niiden viiterajat?
Lääketieteellisen perustan testille löydät täältä: https://www.frontiersin.org/articles/10.3389/fendo.2016.00057/full
https://www.frontiersin.org/article/10.3389/fendo.2016.00057
Käy lataamassa koneellesi Spina-Thyr-ohjelma. http://spina.sourceforge.net/download.html
Käyttöohje englanniksi: https://sourceforge.net/projects/spina/files/Documentation/
Kun olet ladannut ohjelman ja asentanut sen koneellesi, eteesi aukeaa pääikkuna. Valitse ylävasemmalta Edit ja sieltä Preferences, niin pääset asettamaan mittayksiköt ja viitealueet.

Kun rastitat Remember-ruudun, ohjelma muistaa yksiköt. FT4 = T4-V ja FT3 = T3-V. Älä koske muihin arvoihin. Voit tallentaa laboratorioviitteet haluamaasi paikkaan napilla Save to file. Painettuasi OK pääset takaisin alkunäyttöön.
Syötä sinne mittaustulokset.
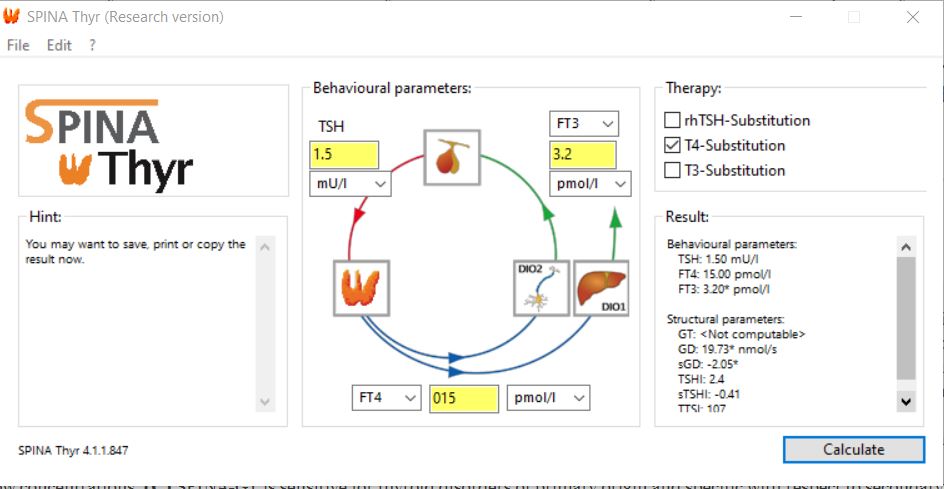
Merkitse lääkityksesi. Jos käytät tyroksiinia, rastita T4-substitution. Muuntoa ei voi laskea, jos käytät T3-lääkettä.
Klikkaa sitten Calculate (laske). Oikeaan alanurkkaan ilmestyy labratuloksiin liittyviä arvoja. GD tarkoittaa muunnon aktiivisuutta. Jos siinä näkyy tähti, se tarkoittaa ettet muunna tarpeeksi tyroksiinia T3:ksi. GT:n kohdalla lukee ”ei laskettavissa”, koska olin laittanut T4-korvaushoidon kohdalle rastin. Ilman rastia siihenkin olisi ilmaantunut laskettu arvo. Alla esimerkki:

Ohjelman kehitti endokrinologi, tohtori Johannes W. Dietrich professori Hoermannin tutkimusryhmästä.
Endokrinologien tiedettä
Lähes kaikissa kilpirauhasta koskevissa teksteissä lukee, että kilpirauhashormonia T3 syntyy 20 % kilpirauhasessa ja 80 % muualla kehossa dejodinaation aikaansaamassa muunnossa, sekä että kilpirauhanen tuottaa hormoneja T4 ja T3 suhteessa 14:1.
Potilaat ovat etsineet lähteitä tähän, mutta vain yksi ainoa lähde on löytynyt (yleensä tieteessä sanotaan, ettei yksi lähde riitä): Pilon tutkimus vuodelta 1990.
Pilon ryhmä tutki kokonaista 14 kilpirauhasterveen ihmisen kilpirauhashormonituotantoa. Otanta oli niin pieni, että oikeasti arvoista ei voida laskea hajontaa. Jostain syystä osallistujille annettiin 56 kertaa suurempi annos jodia, kuin mitä nykyisin pidetään Yhdysvalloissa saannin ylärajana vuorokaudessa. Tämä on saattanut sotkea mittaustuloksia kautta linjan.
Koehenkilöiden arvot vaihtelivat laajalla skaalalla, eikä kilpirauhasen tuottama T4/T3 ollut tasan 14:1. Itse asiassa se vaihteli välillä 6,4 – 71,5. Muunnon osuus kokonais-T3-tuotannosta vaihteli 58 ja 93,5 prosentin välillä.
Kokosin tämän kirjoituksen kannalta mielenkiintoisimmat arvot taulukkoon. Siitä näkee, että vaihtelu yksilöiden välillä oli erittäin suurta. Koehenkilöt olivat siis terveitä, eikä tätä tutkimusta tehty lääkeannosten selvittämiseksi. Tästä ei mitenkään voi päätellä, että kilpirauhanen tuottaa tasan 5 ug T3:a vuorokaudessa, tai että tämä olisi suurin tarvittava lääkeannos korvaushoidossa. Mikäli kilpirauhanen on tuhoutunut eikä muunto toimi, ollaan lähempänä 20 – 40 ug vuorokausiannosta + imeytymishäviöt.

Koejoukosta siis mitattiin alkuparametrit verikokein ja mittauksin. Sitten heille annettiin radiojodilla merkittyä T4- ja T3-hormonia ja seurattiin niiden poistumista kehosta.
Taulukossa on merkitty paksulla mustalla suurimmat arvot ja punaisella pienimmät.
ETA:n suositus yhdistelmähoidosta vuodelta 2012 alkaa näin:
”Introduction
Hypothyroidism is a condition characterized by the clinical and biochemical manifestations of thyroid hormone deficiency in the target tissues of thyroid hormone. The most common cause of hypothyroidism is deficient production of thyroid hormones by the thyroid gland. Thyroxine (T4) is produced exclusively by the thyroid gland; its daily production rate is about 100 g at an average body surface area of 1.79 m 2 (56.2 g/day/m 2). Daily production rate of triiodothyronine (T3) for a body surface area of 1.79 m 2 is about 29 g (16 g/day/m 2): 20% ( 6 g, or 3.3 g/day/m 2 ) is secreted by the thyroid gland, and 80% ( 23 g, or 12.7 g/day/m 2) is generated in extrathyroidal tissues by 5 -deiodination of T4 [1]”
1 Pilo A, Iervasi G, Vitek F, Ferdeghini M, Cazzuola F, Bianchi R: Thyroidal and peripheral
production of 3,5,3 -triiodothyronine in humans by multicompartmental analysis. Am J
Physiol 1990;258:E715–E726.
Pilon tutkimusraportti on siis ETA:n suosituksen ensimmäinen kirjallisuusviite!
Pilon tutkimukseen ja ennen kaikkea sen soveltamiseen liittyvää kritiikkiä löytyy lisää englanniksi täältä: https://thyroidpatients.ca/?s=pilo&x=0&y=0&orderby=relevance&order=DESC
Näin meillä kiusataan potilasta
Potilas oli tyytyväisenä käyttänyt kilpirauhasen vajaatoimintaan yhdistelmäterapiaa T4 + T3 eri muodoissaan 10 vuoden ajan. Hän oli päätynyt siihen, koska tyroksiini oli vähitellen lakannut toimimasta, ja hänelle tuli täydellinen aivosumu ja aloitekyvyttömyys. Hän ei osannut enää laskea 2 + 2, vaikka hänellä oli takanaan korkeamman matematiikan opintoja yliopistotasolla.
Muutamaa vuotta aiemmin yksityinen sisätautilääkäri oli lähettänyt hänet kilpirauhasen ultraäänikuvaan, josta ilmeni että autoimmuunitulehdus oli surkastuttanut kilpirauhasen lähes olemattomaksi. Tällainen kilpirauhanen ei tuota enää juuri mitään hormoneja.
Viime vuonna potilas joutui sairaalaan muun syyn takia. Häneltä otettiin pois omat lääkkeet, ja tilalle määrättiin tyroksiinia, vaikka potilas kertoi ettei elämänlaatu sillä ole hyvä. Potilasta kohdeltiin kuin tämä ei tietäisi mistään mitään, ja hänelle kerrottiin aivan suoraan, että hänen lääkkeensä ovat laittomia, ja hänet yritettiin saada tuomitsemaan ne lääkärit, jotka olivat niitä hänelle määränneet. Kovasti yritettiin myös saada selville, kuka nyt viimeksi on määrännyt näitä ”kiellettyjä lääkkeitä”, jotka ovat lääkeluettelossa ja Fimean sallimia erityislupalääkkeitä (T3).
Väitettiin kivenkovaa, että lääkemääräys, joka ei näy Kannassa, on laiton. Myöhemmin on käynyt ilmi, että aivan kotimainen reseptijärjestelmä ei näy Kannassa eikä julkiseen terveydenhuoltoon, saati ulkomailla toimivan lääkärin kirjoittamat EU-reseptit… ovatko nämä siis oikeasti laittomia?
Sen jälkeen konsultoitiin sairaalan johtavaa endokrinologia, kertomatta siitä etukäteen. Ei kerrottu edes jälkikäteen lääkärin nimeä, vaan se selvisi myöhemmin Kannasta.
OYSin pääendokrinologi nosti vähitellen tyroksiinin määrää, koska T3-V, joka siis yllättäen mitattiin, oli alle viitteiden. Lopulta se nousi viitteen alarajalle, jolloin kaikki muut, paitsi potilas, olivat tyytyväisiä. Potilas kärsi taas aivosumusta, ajattelun hitaudesta, ja muista kilpirauhasen vajaatoiminnan oireista. Pian viitealueen alarajaa nostettiin, jolloin se ”erinomainen” T3-V-arvo oli selvästi alle viitteiden.
Potilas tiesi kuitenkin Hoermannin tutkimusryhmän kehittämästä instrumentista, jolla voidaan todeta muunnon riittävyys tai riittämättömyys. Spina-Thyr osoitti, että tämän potilaan muunto ei riitä.

Mutta tätähän lääkärit eivät uskoneet, sillä he uskoivat kaikkitietävään sairaalan endokrinologiin. Tämä taas ei potilaiden käsityksen mukaan oikeasti osaa hoitaa kilpirauhaspotilaita. Seuraavaksi potilas yritti päästä endokrinologin puheille, mutta häntä ei huolittu vastaanotolle. Potilaan arvothan olivat loistavat!
Ilmeisesti ketään täkäläisessä sairaanhoidossa ei kiinnosta, mitä uusia tutkimustuloksia ja mittausmenetelmiä on viimeisen kymmenen vuoden aikana julkaistu.
Suomalaisia endokrinologeja ei ole näkynyt lainkaan ulkomaisissa kilpirauhasta käsittelevissä kongresseissa puhujina.
Wiersinga: T4 + T3-yhdistelmähoito: onko nähtävissä edistystä?
Endocrine (2019) 66:70–78
https://doi.org/10.1007/s12020-019-02052-2
KATSAUS
T4 + T3-yhdistelmähoito: onko nähtävissä edistystä?
Wilmar M. Wiersinga1
Vastaanotettu: 15. heinäkuuta 2019 / Hyväksytty: 5. elokuuta 2019 © Tekijä (t) 2019
Yhteenveto
T4 + T3-yhdistelmähoidon hoitosuositus julkaistiin vuonna 2012. Tässä katsauksessa selvitetään, ymmärretäänkö asia paremmin 7 vuotta myöhemmin. Tyytymättömyys T4-monoterapiaan on edelleen suurta. Pysyvät oireet koostuvat pääasiassa väsymyksestä, painonnoususta, muistin ja ajattelun ongelmista sekä mielialan häiriöistä. T4-monoterapia liittyy alhaisiin seerumin T3-tasoihin, jotka vaativat usein TSH:ta alle viitealueen painavia L-T4-annoksia T3-V:n normalisoimiseksi. Perifeerisen kudoksen kilpirauhasen toimintakokeet T4-hoidon aikana osoittavat lievää kilpirauhasen liikatoimintaa TSH:lla <0,03 mU/l, ja lievää kilpirauhasen vajaatoimintaa TSH:lla 0,3-5,0 mU/l; kudokset ovat lähinnä eutyreoosia, kun TSH on välillä 0,03-0,3 mU/l. Tämä selittyy löydöksellä, jossa todetaan, että vaikka T4 yleensä ubikitinoituu ja sitä kautta hajoaa, hypotalamuksen T4 on melko vakaa ja vähemmän herkkä ubikitinaatiolle ja hajoamiselle. Normaali seerumin TSH ei siksi välttämättä osoita eutyreoosia. Pysyvät oireet LT4:llä hoidetuilla potilailla ymmärretään puutteellisesti normaalista seerumin TSH:sta huolimatta. Yksi hypoteesi on, että DIO2-geenissä, (jota tarvitaan T3:n paikalliselle muunnolle T4:stä) oleva muunnos, SNP (Thr92Ala), häiritsee sen kinetiikkaa ja/tai vaikutusta, johtaen aivojen paikalliseen kilpirauhashormonin puutteeseen. Pysyvien oireiden tehokasta hoitoa ei ole vielä toteutettu. T4 + T3 -yhdistelmähoitoa voidaan kokeilla valituilla potilailla kokeellisena n =1-tutkimuksena. Vuoden 2012 ETA-hoitosuositus pätee edelleen tähän tarkoitukseen. Hyvin suunnitellut satunnaistetut kliiniset tutkimukset valituilla potilailla ovat avainasemassa edistymisen saavuttamiseksi. Tänä aikana koko asia on monimutkaistunut kaupallisten ja poliittisten vaikutusten takia, mikä käy ilmi T3-tablettien hintojen kovasta noususta Britanniassa, aggressiivisista painostusryhmistä ja Britannian ylähuoneessa tehdyistä esityksistä.
Wilmar M. Wiersinga
wmwiersinga@amc.uva.nl1
Endokrinologian ja aineenvaihdunnan laitos, Akateemisen lääketieteen keskus, Amsterdamin yliopisto, Amsterdam, Alankomaat
Avainsanat: Hypotyreoosi ● Yhdistelmähoito ● T4 ● T3
Johdanto
Vuonna 2012 Euroopan kilpirauhaslääkärien yhdistys (ETA) julkaisi ensimmäisen hoitosuosituksen T4 + T3-yhdistelmähoidosta kilpirauhasen vajaatoiminnassa [1]. Nyt on kulunut seitsemän vuotta, ja mietin, onko asiassa edistytty. Haluaisin käsitellä tätä kysymystä esittämällä samat kysymykset kuin vuoden 2012 hoitosuosituksissa esitettiin.
Onko L-T4:llä hoidetuilla kilpirauhasen vajaatoimintapotilailla tyydyttämätöntä hoitotarvetta?
Vuonna 2012 ilmoitettiin, että 5-10%:lla levotyroksiinilla (L-T4) hoidetuista kilpirauhasen vajaatoiminnasta kärsivistä potilaista, joilla oli normaali seerumin TSH, oli kilpirauhassairauteen ja L-T4-terapiaan liittyviä oireita (heikentynyt elämänlaatu, psykologinen stressi ja kognitiiviset häiriöt) [1]. Tämä lausunto perustui kolmeen väestöpohjaiseen tutkimukseen Yhdistyneestä kuningaskunnasta, Alankomaista ja Norjasta [2 – 4]. Sen jälkeen väestössä ei ole enää tehty tutkimuksia, mutta vuonna 2017 American Thyroid Association (ATA) -sivustolla (Yhdysvaltain kilpirauhaslääkärien yhdistys) julkaistu kilpirauhasen vajaatoimintapotilaiden kyselytutkimus osoitti huomattavaa tyytymättömyyttä hoitoon [5]. Niiden vastaajien keskuudessa, joilla ei ollut heidän itse ilmoittamaansa masennusta, elämän stressitekijöitä tai sairauksia (n = 3670), tyytyväisyys asteikolla 1-10 L-T4:llä oli 5 (IQR 3-7), tyytyväisyys L -T4 + L-T3:llä oli 6 (IQR 3-8), ja tyytyväisyys potilailla, jotka käyttivät kuivattua kilpirauhasuutetta (DTE), oli korkein (pistemäärä 7, IQR 5-9) (p <0.0001). Niiden joukossa, jotka olivat tyytymättömiä hoitoonsa (~ 22% vastaajista, jotka ottivat L-T4:ta tai L-T4 + L-T3:ta, ja 14% DTE:n käyttäjistä), asiaankuuluvat alueet, joiden tunnistettiin aiheuttavan tyytymättömyyttä, oli väsymys tai energiataso (77%), painonhallinta (69%), muisti tai muut älylliset ongelmat (58%) ja mieliala (45%) [5]. Kyselyn tulokset ovat todennäköisesti harhaisia, koska tyytymättömät potilaat ovat todennäköisemmin osallistuneet tutkimukseen kuin potilaat, jotka olivat tyytyväisiä hoitoonsa. Toinen harha saattaa olla suhteellisen suuri subkliinisen kilpirauhasen vajaatoiminnan osuus osallistujien keskuudessa, koska viime vuosikymmeninä tyroksiinin korvaaminen on aloitettu vähitellen aiempaa alhaisemmilla seerumin TSH-pitoisuuksilla (vuonna 2009 keskimääräisen TSH: n ollessa 7,9 mU/l) [6]. Viimeaikaiset tutkimukset eivät ole osoittaneet kilpirauhaseen liittyvien oireiden lievenemistä tai elämänlaadun paranemista subkliinisen kilpirauhasen vajaatoiminnan levotyroksiinihoidon jälkeen, etenkään vanhemmilla henkilöillä [7 – 9]. Tyytymättömyys hoidon lopputulokseen voisi siten liittyä monien subkliinistä kilpirauhasen vajaatoimintaa sairastavien vanhempien potilaiden osallistumiseen kyselytutkimukseen.
Onko L-T4: llä hoidettujen kilpirauhasen vajaatoimintapotilaiden valituksille olemassa biologinen peruste?
Vuonna 2012 havaittiin viisi mahdollista syytä jatkuville valituksille [1].
1. Taudin krooniseen luonteeseen liittyvät epäspesifiset syyt
Tietoisuus kroonisesta sairaudesta ja kilpirauhaslääkkeiden elinikäisestä riippuvuudesta voivat tehdä potilaista onnettomia ja vähemmän terveitä [1]. Ei ole tehty eteneviä tutkimuksia, joiden avulla olisi testattu hypoteesia siitä, eroavatko potilaiden asenteet, terveyskäsitykset ja mieliala ennen L-T4-hoitoa heillä, joilla on jäljellä oireita heistä, joilla ei ole jäännösoireita hoidon jälkeen. Laadulliset haastattelututkimukset osoittavat, että potilailla on yleensä heikko ymmärrys tilastaan [10]. Kun he kokevat kilpirauhasen vajaatoiminnan oireita alkuperäisen diagnoosin yhteydessä, tautiherkkyyden tunne (ja sitoutuminen L-T4:ään) on parempi, mutta potilaat, jotka voivat huonosti normaalista seerumin TSH-arvosta huolimatta, tunsivat jäävänsä ilman jatkoselvittelyjä normaalin laboratoriotuloksensa vuoksi. Yleislääkärien ja hoitajien keskuudessa tehdyt laadulliset tutkimukset ovat paljastaneet riittämätöntä osaamista lääkkeiden keskinäisvaikutuksista ja levotyroksiinin farmakokinetiikasta [11]. Ammattilaiset luottavat enemmän verikokeiden tuloksiin kuin kliinisiin oireisiin tyroksiiniannoksen säätämisessä. Tietojen vaihtoa rajoittaa yleensä aika ja se keskittyy usein oireisiin eikä potilaan koulutukseen. Huonon lääkehoidon suurimmaksi syyksi todettiin potilaiden heikko sitoutuminen lääkehoitoon, vaikka muutkin tekijät, kuten muut sairaudet ja lääkitykset mainittiin. Tästä seuraa, että lääkäreiden ja potilaiden vuorovaikutuksen parantaminen voisi vähentää kilpirauhasen optimaalisen lääkehoidon esteitä.
2. Liittyvät autoimmuunisairaudet
Liittyviä autoimmuunisairauksia esiintyy 14%: lla potilaista, joilla on Hashimoton tauti, ja 10%:lla potilaista, joilla on Basedowin tauti [12]. Ei tiedetä, kuinka usein jäljelle jääneet oireet johtuvat huomioimatta jääneistä liittyvistä autoimmuunisairauksista.
3. Kilpirauhasen autoimmuniteetti itsessään
On edelleen epäselvää, johtuvatko tietyt oireet kilpirauhasen autoimmuniteetista itsestään. Esimerkiksi pelkästään TPO-vasta-aineiden esiintyminen muuten eutyreoottisissa henkilöissä on liitetty masennukseen joissakin väestöpohjaisissa tutkimuksissa, mutta ei toisissa [1]. Kilpirauhasen antigeenien täydellinen poisto täydellisellä tyreoidektomialla (kilpirauhasen poistoleikkaus) aiheuttaa kilpirauhasen vasta-aineiden asteittaisen häviämisen. Jotta voitiin selvittää, parantavatko tyreoidektomiat oireita, jotka jatkuivat Hashimoton kilpirauhastulehduksesta kärsivillä potilailla, vaikka heillä oli normaalit kilpirauhasen toimintakokeet samalla, kun he saivat kilpirauhashormonikorvaushoitoa, tehtiin satunnaistettu kliininen tutkimus, jossa verrattiin täydellistä tyreoidektomiaa lääkehoidon jatkamiseen [13]. Täydellinen tyreoidektomia paransi terveyteen liittyvää elämänlaatua ja väsymystä, kun taas lääkehoito ei parantanut niitä. 18 kuukauden kohdalla mediaani-TPO-Ab-arvot laskivat 2232:sta 152 kU/l:aan leikkausryhmässä ja 2052:sta 1300 kU/l:aan lääkehoitoa saaneessa ryhmässä.
4. L-T4-annoksen riittämättömyys
Aikaisempien tutkimusten mukaan L-T4:ää käyttävillä NHANES-tutkimuksen osallistujilla, joilla oli normaali seerumin TSH, seerumin kokonaisen ja vapaan T4:n pitoisuudet ovat korkeammat, ja kokonaisen ja vapaan T3:n pitoisuudet matalammat kuin terveillä tai vastaavilla verrokeilla [14]. Alle viiterajan olevia T3-V-arvoja havaitaan noin 15%:lla levotyroksiinia saavista kilpirauhasen vajaatoiminnasta kärsivistä potilaista [15]. Siksi voidaan kysyä, voisiko matala seerumin T3-taso olla syynä jäännösoireille, ja edellyttääkö se suurempia L-T4-annoksia T3-tasojen normalisoimiseksi. Tämä ei kuitenkaan vaikuta kovin todennäköiseltä. Hieman pienemmät tai korkeammat L-T4-annokset eivät tuottaneet mitattavissa olevia muutoksia kilpirauhasen oireissa, hyvinvoinnissa tai elämänlaadussa [16, 17], eikä merkittäviä eroja aineenvaihdunnassa [18]. Toisessa tutkimuksessa arvioitiin täydellisen tyreoidektomian vaikutusta, joka poistaa kilpirauhasen T3-erityksen kokonaan [19]. Leikkauksen jälkeisiä T3-V-tasoja tyroksiinihoidon aikana verrattiin ennen leikkausta vallinneeseen seerumin T3-V-tasoon samoilla yksilöillä: leikkauksen jälkeinen T3-V oli korkeampi kuin ennen leikkausta potilailla, joilla leikkauksen jälkeinen TSH oli <0,03 mU/l, muuttumaton potilailla, joilla leikkauksen jälkeinen TSH oli 0,03-0,3 mU/l ja alempi potilailla, joilla on leikkauksen jälkeinen TSH 0,3-5,0 mU/l [19]. Nämä tutkimukset viittaavat siihen, että tarvitaan tyroksiinin TSH-suppressiivisia annoksia seerumin T3-tasojen pitämiseksi samanlaisina kuin ennen kilpirauhasen poistoa. Se tarjoaa perustelun T3-korvaushoidolle [20]. Ei kuitenkaan ole olemassa hyvää näyttöä siitä, että alhainen seerumin T3-V tai alhainen T3-V / T4-V-suhde olisi yhteydessä pysyviin oireisiin. Alhaisesta seerumin T3-V:sta L-T4-hoidon aikana vastuussa oleva mekanismi liittyy tyypin 2 dejodinaasiin (DIO2). Tämä entsyymi katalysoi T4:n dejodinaatiota T3:ksi kilpirauhasen ulkopuolisissa kudoksissa ylläpitäen siten seerumin T3-tasoja tyroksiinihoidon aikana. DIO2:lla on lyhyt puoliintumisaika (≈60 min.), joka lyhenee edelleen (20 min) vuorovaikutuksessa T4:n kanssa, mikä johtaa DIO2:n ubikitinaatioon ja proteosomaaliseen hajoamiseen [21]. Hypotalamuksen DIO2 on, toisin kuin muut kudokset, melko vakaa ja vähemmän herkkä ubikitinaatiolle [22]. Siten, kun muussa kehossa DIO2-välitteinen T3-tuotanto vähenee asteittain kasvavilla L-T4-annoksilla DIO2:n ubikitinaation vuoksi, hypotalamuksen/aivolisäkkeen T3-tuotanto ei vähene, ja seerumin TSH:n normalisoimiseksi tarvittava L-T4-annos on pienempi kuin seerumin T3:n normalisoiva annos. Tästä seuraa, että normaalin seerumin T3-V-tason saavuttamiseksi on annettava suhteellisen suuri L-T4-annos, joka todennäköisesti painaaa seerumin TSH:n hyvin matalaksi.
5. L-T4-hoitomuodon riittämättömyys
Taulukko 1 Perifeerisen kudoksen kilpirauhasen toimintakokeet 133 potilaalla ennen täydellistä tyreoidektoomiaa ja vuosi leikkauksen jälkeen L-T4-lääkityksellä [ 23 ] LDL-C LDL-kolesteroli, SHBG sukuhormoneja sitova globuliini, TRACP tartraattiresistentti hapan fosfataasi, BAP luun alkalinen fosfataasi, NS ei merkitsevä, ↓ merkitsevä pudotus, ↑ merkitsevä nousu, preop ennen leikkausta, postop leikkauksen jälkeen |
Perifeerisen kudoksen kilpirauhasen toimintakokeet tyroksiinihoidolla on arvioitu ennen täydellistä tyreoidektomiaa ja vuosi leikkauksen jälkeen [23]. Potilailla, joilla leikkauksen jälkeinen oli TSH ≤ 0,03 mU/l, oli lievä liikatoiminta kudostasolla, potilailla, joiden TSH oli välillä 0,03 – 0,3 mU/l, perifeeristen kudosten toimintakokeet olivat lähinnä eutyreoosia ja potilailla, joilla TSH oli välillä 0,3-5,0 mU/l, potilaalla oli lievä kudoksen kilpirauhasen vajaatoiminta (taulukko 1). L-T4:n korvaaminen annoksilla, jotka normalisoivat seerumin TSH:n, ei normalisoi kaikkia kilpirauhashormonin signaloinnin systeemisiä markkereita, mukaan lukien seerumin LDL-kolesteroli ja kokonaiskolesteroli [24]. Normaali seerumin TSH ei siis ole tae kaikissa kohdekudoksissa esiintyvästä eutyreoosista [15, 25]. On pääteltävä, että L-T4 -hoito ei kykene aikaansaamaan eutyreoosia samanaikaisesti kaikissa kohdekudoksissa. Juuri se johtopäätös, jonka Escobarit tekivät heidän nykyisin tunnetuissa kokeissaan kilpirauhashormonin korvaamisesta kilpirauhasen vajaatoiminnassa: vain L-T4+L-T3-yhdistelmä voi varmistaa samanaikaisen eutyreoosin kaikissa kudoksissa [1]. Vaikka L-T4 ei ehkä ole ihanteellinen kilpirauhashormonin korvaushoito, suurin osa potilaista on tyytyväinen sen tulokseen. Ei ymmärretä, miksi osa potilaista kokee jatkuvia oireita. On oletettu, että kyseessä on tietty yksittäisen nukleotidin polymorfismi (SNP) DIO2:ssä, nimittäin Thr92Ala. Mielenkiinto tähän snippiin heräsi varhaisesta löydöstä, että Thr92Ala liittyi heikentyneeseen psyykkiseen hyvinvointiin tyroksiinimonoterapialla ja parempaan vasteeseen T4+T3-yhdistelmäterapialla [26]. Jopa 80% aivojen solunsisäisestä T3:sta syntyy T4:n paikallisesta dejodinaatiosta T3:ksi, jota katalysoi D2. Eräät tutkimukset osoittavat vähentynyttä D2-aktiivisuutta Thr92Ala:n läsnä ollessa [27], mutta toiset huomioivat SNP:n normaalia entsyymikinetiikkaa [28]. Hollantilainen väestöpohjainen tutkimus raportoi, että tämän D2-polymorfismin Ala/Ala-genotyyppi esiintyy 11,3%:lla T4:n käyttäjistä ja 10,7%:lla koko väestöstä; kummassakaan ryhmässä SNP ei liity seerumin TSH:n, T4-V:n, T3-V:n tai T3-V/T4-V-suhteen eroihin, terveyteen liittyvään elämänlaatuun eikä kognitiiviseen toimintaan [29]. Äskettäin Thr92Ala-proteiiniin liittyviä solujen poikkeavuuksia on tutkittu edelleen. Proteiinin Ala92-version puoliintumisaika on pidempi kuin villityypin, se sijaitsee ektooppisesti (poissa normaalilta paikaltaan) Golgin laitteessa ja muuttaa ihmisten aivojen tiettyjen alueiden geneettistä profiilia tavalla, joka muistuttaa neurodegeneratiivista sairautta, ilman todisteita vähentyneestä kilpirauhashormonin signaloinnista [30]. Viimei-simmän tutkimusraportin mukaan D2 on kuljettajaproteiini, joka kierrättää ER:n (endoplasminen retikulum, solulimassa oleva onteloinen kalvosto, solulimakalvosto) ja Golgin laitteen välillä [31]. Thr92-Ala-substituutio aiheuttaa ER-stressiä, aktivoi laskostumattoman proteiinin vasteen (UPR), kertyy trans-Golgiin ja tuottaa vähemmän T3:ta. Hiirellä, jolla on Ala92 DIO2-muunnos, esiintyy UPR:aa ja kilpirauhashormonien puutetta eri aivoalueilla, kun taas ulkopuolelta annettu L-T3 parantaa älyllistä suoriutumista. Primääri kilpirauhasen vajaatoiminta vahvistaa Ala92 DIO2 -fenotyyppiä, vastaten vain osittain tyroksiiniin. On pääteltävä, että edelleen ymmärretään huonosti jatkuvien valitusten alkuperä L-T4: llä hoidetuilla kilpirauhasen vajaatoiminnasta kärsivillä potilailla, joilla on normaali seerumin TSH. Toisaalta voidaan myös päätellä, että L-T4-monoterapia ei todennäköisesti ole ihanteellinen tapa korvata kilpirauhashormonien puute. Endokrinologien keskuudessa vuonna 2013 tehdyssä tutkimuksessa kävi ilmi, että kun potilailla oli pysyviä oireita TSH-tavoitearvojen saavuttamisesta huolimatta, 84% vastaajista testasi muita syitä, 11% lähetti potilaan perusterveydenhoitoon ja 3,6% vaihtoi L-T4+L-T3-yhdistelmään; 22% mittasi T3-V:n [32].
Onko todisteita siitä, että L-T4+L-T3-yhdistelmähoito auttaa kilpirauhaspotilaita paremmin kuin L-T4-monoterapia?
Vuoden 2006 meta-analyysissä, jossa 11 RCT:ssä (satunnaistettu kontrolloitu tutkimus) verrattiin L-T4-monoterapiaa L-T4+L-T3-yhdistelmähoitoon, ei löytynyt eroja eri lopputuloksissa (elämänlaatu, kognitio, mieliala tai oireet) [1]. Haittavaikutukset eivät myöskään eronneet hoitojen välillä. Viimeisimmässä RCT:ssä ei myöskään ole eroja [33]. Monia, ellei kaikkia RCT-tutkimuksia, voidaan kritisoida monissa suhteissa, esimerkiksi valintaharhasta, joka johtuu etiologialtaan ja ennusteeltaan heterogeenisten potilasryhmien sisällyttämisestä koejoukkoon, todellisen vaikutuksen laimentamisesta oireisten potilaiden pienellä osuudella, pienen otannan, vääristä TSH-tavoitearvoista, muunnon tehok-kuusvaihtelun aiheuttamasta sekoittavasta tekijästä, hoitovasteen laajasta vaihtelusta ja elämänlaatuinstrumentin pienestä vaikutuskoosta [34]. Seitsemässä RCT-tutkimuksessa potilailta kysyttiin, mitä tiettyä hoitojaksoa he pitivät parempana: 48% piti parempana T4+T3-hoitoa, 25% piti parempana T4-hoitoa ja 27%:lla ei ollut väliä [1]. Potilaat, jotka satunnaistettiin saamaan T4 + T3-hoitoa, pudottivat 0,5-1,5 kg, kun taas potilaat, jotka satunnaistettiin T4:lle, pudottivat 0,1-0,5 kg. Viimeaikaiset tutkimukset eivät kuitenkaan ole pystyneet vahvistamaan mieltymysten ja kehon painon muutosten välistä suhdetta [35, 36]. Kaikissa hoitosuosituksissa todetaan, että L-T4:n tulisi olla ensisijainen hoito kilpirauhasen vajaatoimintapotilaille [37].
Voisiko olla niin, että tutkimuksia, joissa verrataan L-T4 + L-T3 -yhdistelmähoitoa ja L-T4-monoterapiaa, ei ole kohdistettu oikealle populaatiolle?
Tämä on hyvinkin mahdollista. Tulokset saattavat olla erilaisia, kun sovelletaan erilaisia valintaperusteita. Uudet RCT:t voidaan harkita rajoitettaviksi potilaisiin, joilla on pysyviä oireita ja/tai erityisiä genotyyppejä, kuten Thr92Ala DIO2. Muitakin polymorfismeja pitäisi harkita tutkittaviksi, kuten aivoille spesifin kilpirauhashormoni-kuljettajaproteiinin OATP1C1n SNP:t, jotka on liitetty uupumukseen ja masennukseen, mutta ei neurokognitiiviseen toimintaan eikä T4:n+T3:n pitämiseen parempana [1]. Mielenkiintoista kyllä, tanskalainen RCT löysi kaksi SNP: tä (Thr92Ala DIO2 ja rs17606253 MCT10 -monokarboksylaatti-kuljettajaproteiini 10), jotka liittyvät suosituimpaan hoitoon: T4+T3 -hoito oli mieluisempi 42%:lla, kun molemmat SNP:t puuttuivat, 63% kun toinen oli läsnä, ja 100%, jos molemmat SNP:t olivat läsnä [35].
Ketkä potilaat voivat saada L-T4 + L-T3 -yhdistelmähoidon?
Vuoden 2012 ETA-ohjeissa ehdotetaan, että “L-T4+L-T3-yhdistelmähoitoa voidaan pitää kokeellisena lähestymistapana lääkitystä noudattavilla, L-T4-hoidetuilla kilpirauhasen vajaatoimintapotilailla, joilla on jatkuvia oireita huolimatta viitealueella olevista seerumin TSH-arvoista, jos he ovat aiemmin antaneet tukensa kroonisen sairautensa hoitamiseksi, ja siihen liittyvät autoimmuunisairaudet on suljettu pois. T4+T3-yhdistelmähoitoa ei suositella raskaana oleville naisille eikä potilaille, joilla on sydämen rytmihäiriöitä” [1]. Italialaiset ja brittiläiset kilpirauhaslääkärien yhdistykset ovat hyväk-syneet nämä suositukset, kun taas ATA:lla on neutraalimpi kanta [37]. Edelleen ehdotetaan, että yhdistelmähoito lopetetaan, jos oireet eivät ole vähentyneet kolmen kuukauden kuluttua. Huoli T4+T3-yhdistelmähoidon pitkäaikaisesta turvallisuudesta on edelleen olemassa, mutta Skotlannissa tehdyn 17-vuotisen havainnoivan väestötutkimuksen tulokset, jotka koskevat liotyroniinin (T3) käyttöä, ovat rauhoittavat [38]. Verrattuna potilaisiin, jotka ottavat vain L-T4: tä (n = 33955), potilailla, jotka käyttivät L-T3:ta (joko L-T4:n kanssa tai ilman, n = 400), ei ollut suurentunut sydän- ja verisuonisairauksien, eteisvärinän tai murtumien riski ikäkorjauksen jälkeen. Bisfosfonaatti- tai statiinireseptien lukumäärässä ei ollut eroa, mutta antipsykoottisten lääkkeiden uusien reseptien riski oli lisääntynyt (riskisuhde 2,26, CI 1,64-3,11), suhteessa L-T3-reseptien määrään [38]. Vuonna 2017 ATA:n jäsenten keskuudessa etsittiin tekijöitä, jotka johtaisivat vaihtoehtoisiin hoitomuotoihin T4:llä hoidetuilla kilpirauhasen vajaatoiminnasta kärsivillä potilailla [39]. Erityisesti oireiden esiintyminen (mukautettu todennäköisyys 25,6), mutta myös alhainen seerumin T3, DIO2 -polymorfismi ja potilaan pyyntö (mukautettu todennäköisyys 2,3-2,6) lisäsi lääkärin halukkuutta määrätä T3:a sisältävää terapiaa, kun taas korkeampi ikä ja muut sairaudet heikensivät halukkuutta. Kilpirauhasen puuttumisella, sukupuolella ja painoindeksillä ei ollut vaikutusta. Yhdistelmähoidon kysyntä lisääntyy Yhdysvalloissa, Kanadassa, Australiassa ja useimmissa Euroopan maissa [40, 41]. Tätä kuvaa hyvin T4+T3-hoidon korvaushakemusten jyrkkä 3,8-kertainen kasvu Tanskassa heinäkuun 2012 – kesäkuun 2013 ja heinäkuun 2013 – kesäkuun 2014 välisenä aikana (kuva 1) [41]. Tämä valtava kasvu johtui todennäköisesti kilpirauhasen vajaatoiminnan ja sen hoidon saamasta laajasta julkisuudesta tiedotusvälineissä. Näyttää siltä, että T4+T3-asiasta on tullut todellinen “hype”. Tanskalaisessa julkaisussa on myös paljon tietoa siitä, mitä tosielämässä tapahtuu yhdistelmähoidon suhteen (taulukko 2) [41]. Tietysti vuoden 2012 ETA-ohjeita ei noudateta monissa tapauksissa. Ohjeissahan suositellaan reseptien määräämistä ja annoksen muuttamista valtuutettujen sisätautilääkäreiden tai endokrinologien toimesta, ei yleislääkärien eikä lainkaan potilaiden itsensä toimesta. Huolestuttavaa on niiden potilaiden suuri osuus, joiden seerumin TSH:n ollessa diagnoosin aikaan <10 mU/l, mikä tarkoittaa, että heillä oli subkliininen kilpirauhasen vajaatoiminta, mikä voi johtaa hoidon hyödyn vähenemiseen ja mahdollisesti ylihoitoon [7, 8, 42].
Mikä on sopiva annos L-T4 + L-T3-yhdistelmähoidossa?
L-T4+L-T3 -yhdistelmähoidon suositeltu annos vuoden 2012 ETA-ohjeissa perustuu siihen olettamaan, että eutyreoosi voidaan saavuttaa samanaikaisesti kaikissa kilpirauhasen vajaatoimintapotilaiden kudoksissa vain LT4+L-T3-annossuhteella, joka jäljittelee ihmisen kilpirauhasen fysiologista T4:n ja T3:n erityssuhdetta (joka on lähellä painosuhdetta 13: 1) [1]. Morreale de Escobarin ym. kokeellisista eläintutkimuksista johdettu olettama voi olla tai ei olla totta. L-T4: n ja L-T3: n farmakodynaaminen vastaavuus on arvioitu satunnaistetussa,
Kuva 1 L-T4 + L-T3-yhdistelmähoidon korvaushakemusten määrä Tanskassa kasvoi 3,8-kertaisesti ajalla heinäkuu 2013 – kesäkuu 2014 verrattuna aikaan heinäkuu 2012-kesäkuu 2013, todennäköisesti voimakkaan kilpirauhasen vajaatoiminnan ja sen hoidon mediajulkisuuden aiheuttamana [ 41 ]
kaksoissokkoutetussa, ristikkäistutkimuksessa 10:llä potilaalla, joilta on poistettu kilpirauhanen [43]. Tavoite (TSH ≥ 0,5 mU/l, mutta enintään 1,5 mU/l vähintään 30 päivän ajan) saavutettiin keskimääräisellä päiväannoksella, joka oli joko 115 ± 38,5 μg L-T4 tai 40 ± 11 μ.g L-T3 (L-T4:n ja L-T3:n suhde 0,36 ± 0,06). Pääteltiin, että L-T4:n terapeuttinen korvaaminen L-T3:lla saavutettiin suhteessa noin 3:1. Toisin sanoen 30 μg T4 voidaan korvata 10 μg:lla T3 ilman muutoksia seerumin TSH:ssa. Siten yksinkertainen menetelmä halutun annossuhteen saavuttamiseksi L-T4:n ja L-T3:n välillä on seuraava. Annos x on päivittäinen L-T4-annos, μg, joka on johtanut normaaliin seerumin TSH-arvoon. Tarvittava päivittäinen L-T3-annos μg (nimeltään y) saadaan muodossa y = x: 20. Pyydetty päivittäinen L-T4-annos, μg (nimeltään z), saadaan muodossa z = x − 3y (taulukko 3) [1]. L-T4 voidaan antaa kerran päivässä, mutta päivittäinen L-T3-annos tulisi jakaa kahteen annokseen, yksi ennen aamiaista ja suurin ennen nukahtamista [1]. Perustelut päivittäisen L-T3-annoksen jakamiselle kahteen (tai jopa kolmeen) annokseen ovat L-T3:n suhteellisen lyhyt puoliintumisaika, seerumin huippupitoisuuden T3-arvot 2-4 tuntia lääkkeenoton jälkeen ja seerumin T3:n fysiologinen vuorokausivaihtelu, jonka huippuarvo on noin kello 4 ja alin arvo noin klo 15–17 [44]. T4+T3-yhdistelmähoito ehdotetaan aloitettavaksi L-T4 L-T3-annossuhteella välillä 13: 1 – 20: 1 [1].
Taulukko 2 “tosielämän” tiedot T4+T3-yhdistelmähoidosta Tanskassa Internet-pohjaisen kyselytutkimuksen [ 41 ]mukaan
| Vastaajat | n = 293 nainen 94%, mies 6%; <40 vuotta 20%, 41-60 vuotta 63%, ≥ 61 vuotta 17%; 1 ° / 2 ° koulutus
11%, ammatillinen tai lyhyt 3 ° koulutus 28%, 3 ° koulutus > 3 v. 60%, ei vastausta 1% |
| Kilpirauhasen vajaatoiminnan kesto | <1 vuotta 4%, 1-3 vuotta 15%, 3-10 vuotta 36%,> 10 vuotta 45% |
| TSH diagnosointihetkellä | En muista 26%; <4 mU/l 26%; 4-10 mU/l 18%; 10-20 mU/l 11%; 20-50 mU/l 6%; > 50 mU/l 12% |
| Oireet ennen T4+T3-hoidon aloittamista | Väsymys 91%, energian puute 87%, kognitiiviset ongelmat 83%, tuki- ja liikuntaelinten oireet 76%, paino-ongelmat 75%, kipu 49%, ummetus 42%, masennus 39% |
| Reseptit | L-T4+L-T3-hoito 43%, kuivattu kilpirauhasuute 50%, muu lääke 7%, sekä L-T3 että kuivattu 1% |
| Annosmuutokset | Lääkäri (verinäytteet) 44%, lääkäri (oireet) 17%, minä (oireet) 28%, ei vastausta (11%) |
| T4 + T3-hoidon kesto | 3-6 kuukautta 56%, 6-12 kuukautta 16%, 1-3 vuotta 14%,> 3 vuotta 10%, ei vastausta 4% |
| Viimeisin TSH | <0,01 mU/l 14%, 0,01-1,0 mU/l 54%, 1,0-2,5 mU/l 14%, 2,5-4,0 mU/l 8%,> 4,0 mU/l 5%, ei vastausta 4% |
| Vaste T4 + T3 -hoitoon | Ihmeellinen 19%, paljon parempi 43%, parempi 22%, ei eroa 6%, huonompi 2%, ei vastausta 8% |
Taulukko 3 Yksinkertainen menetelmä sopivien L-T4- ja L-T3-annosten laskemiseksi T4 + T3-yhdistelmähoidolla [1]
| T4-monoterapian x = L-T4 -annos, joka normalisoi TSH: n | 100 μg L-T4 = annos x | 150 μg L-T4 = annos x | 200 μ g L-T4 = annos x | |
| T4 (annos z) + T3 (annos y) yhdistelmähoito
L-T3-annos y = x: 20 L-T4-annos z = x−3y L-T4-annos (pyöristetty) L-T4: L-T3-annossuhde |
5 μg
85 μg 87.5 μg 17:1 |
7.5 μg
127.5 μg 125 μg 17:1 |
10 μg
170 μg 175 μg 17: 1 |
|
|
Taulukko 4 Saatavana olevat versiot L-T3-tableteista, L-T3 + L-T4 -yhdistelmätableteista ja kuivatetusta kilpirauhasuutteesta [ 44 ] |
||||
| Kauppanimi | T3-annos | T4-annos | Saatavuus | |
| L-T3-tabletit
Cytomel |
5, 25, 50 μg | USA, Kanada, Hollanti | ||
| Thybon | 20, 100 μg | Yhdistynyt kuningaskunta | ||
| Tertroxin | 20 μg | Australia ja Etelä-Afrikka | ||
| Liotyr | 5 μg (pehmeä geeli) | Italia | ||
| L-T3 + L-T4 -tabletit
Prothyroid |
10 μg | 100 μg | Saksa | |
| Novothyral | 5, 15, 20 μg | 25, 75, 100 μg | Eurooppa | |
| Thyreotom forte | 10, 30 μg | 40, 120 μg | Tšekin tasavalta | |
| Kuivattu kilpirauhasuute Nature throid 65 mg eli grainia kohti | 9 μg | 38 μg | Yhdysvallat | |
| Westhroid puhdas 65 mg eli grainia kohti | 9 μg | 38 μg | Yhdysvallat | |
| NP thyroid 60 mg eli grainia kohti | 9 μg | 38 μg | Yhdysvallat | |
| Thyroid (Erfa) 60 mg grainia kohti | 8 μg | 35 μg | Eurooppa, Kanada | |
| Armour thyroid 60 mg grainia kohti | 9 μg | 38 μg | Yhdysvallat | |
Seerumin T3-V/T4-V-suhde (pmol/l – pmol/l) kilpirauhasen vajaatoimintapotilailla, jotka saavat L-T4-korvaushoitoa, on 0,24 (IQR 0,20-0,28), joka on alempi kuin terveiden verrokkien arvo 0,32 (IQR 0,27-0,37) [16]. RCT:ssä seerumin T3-V/T4-V-suhde on 0,30 (IQR 0,25-0,45) L-T4 + L-T3-yhdistelmähoidon aikana, korkeampi kuin arvo 0,24 (IQR 0,18-0,25) L-T4-monoterapian aikana, mutta silti jonkin verran alhaisempi kuin verrokeilla [1]. Tanskalaisessa retrospektiivisessa havainnointitutkimuksessa raportoidaan potilaista, joilla on pysyviä oireita huolimatta L-T4-hoidosta ja normaalista seerumin TSH-arvosta [45]. Hoito muutettiin L-T4 + L-T3-yhdistelmähoidoksi suhteessa 17:1 (paino / paino). 12 kuukauden jälkeen 65% sai avun ja 35% ei saanut apua. Ryhmien välillä ei ollut eroja seerumin T4:n vähenemisessä (vastaavasti-18 ja -4,5 nmol/l) eikä seerumin T3: n nousussa (vastaavasti+0,28 ja +0,25 nmol/l).
Mitä valmisteita voidaan käyttää L-T4 + LT3-yhdistelmähoidossa ja miten niiden käyttöä tulisi seurata?
Vuoden 2012 ETA-ohjeissa suositellaan erillisten L-T4- ja L-T3-tablettien käyttöä yhdistelmähoidossa, koska saatavissa olevien yhdistelmätablettien annossuhteet L-T4 / L-T3 ovat 4:1, 5:1 ja 10:1 (taulukko 4). Nämä suhteet ovat merkitsevästi erilaisia kuin suositellut suhteet 13:1 – 20:1. Jos annoksen säätäminen on tarpeen, on myös kätevämpää muuttaa vain yhden komponentin, mieluummin L-T3:n, annosta [1]. L-T3:n farmakokinetiikan kannalta L-T3:n hitaasti vapauttava valmiste olisi tervetullut, mutta sitä ei ole toteutettu. Thyromaxin, L-T3-tabletin, jonka lisäaineena on mikrokiteinen selluloosa ja magnesiumstearaatti, toivottiin vapauttavan T3:a hitaasti, mutta sen seerumin T3-profiili on samanlainen kuin Cytomelin [ 46 , 47 ]. Yksi annos T3-sulfaattia tuotti vakaan seerumin T3-pitoisuuden 48 tunnin ajaksi, mutta tästä mielenkiintoisesta havainnosta ei ole enää kuulunut mitään [48]. Vuodesta 2012 lähtien on kuitenkin markkinoille tullut matalan pitoisuuden L-T3-tabletteja (kuten 5 μg Cytomelia). Tablettien jakaminen puoliksi on hyödyllistä, jos vaaditaan pieniä annoksia, 2,5 tai 7,5 μg L-T3. Tämän kehityksen taustalla on epäilemättä suuri kiinnostus yhdistelmähoitoon. Tämän kehityksen kielteisenä puolena on pantava merkille tiettyjen lääkeyhtiöiden toteuttama L-T3 -tablettien hintojen nousu, jota ei voida hyväksyä. Esimerkiksi Isossa-Britanniassa yhden 20 μg:n geneerisen L-T3-tabletin hinta nousi yhtäkkiä 0,16:sta 9,22 puntaan. Englannin julkisen terveydenhuollon L-T3-reseptien kokonaiskustannukset olivat 758 975 puntaa elokuussa 2013; määrä nousi melkein kymmenkertaiseksi 7 018 679 puntaan heinäkuuhun 2018 mennessä huolimatta pienemmästä lääkemääräysten määrästä [49]. Tämä kaikki johti laajalle levinneeseen potilaiden huoleen, julkisuuteen tiedotusvälineissä ja aloitteeseen parlamentin ylähuoneessa. Lordi Huntin (Kings Heath) tekemä aloite kuuluu: “Ylähuone pahoittelee, että vuoden 2018 lääketieteellistä lääkehuoltoa (kustannuksia) koskevat säädökset eivät ehdota mitään toimenpiteitä Concordian ja muiden yritysten perimien korkeiden Liothyroninin hintojen suhteen kilpirauhasen vajaatoiminnan hoitamiseksi, jolloin potilaita estetään näin saamasta tätä välttämätöntä lääkettä” [50]. Lopuksi potilaat pitivät kuivattua kilpirauhasuutetta, DTE:tä, parempana verrattuna L-T4: ään RCT:ssä [51] ja verkkosivustopohjaisessa kyselytutkimuksessa [5]. DTE:tä ei suositella hoitosuosituksissa, mutta potilaiden parempana pitämää lääkettä tulisi tutkia perusteellisemmin.
Taulukko 5 Vuoden 2012 ETA-suosituksissa esitetyt, tulevia tutkimuksia koskevat ehdotukset L-T4 + L-T3:n käytöstä kilpirauhasen vajaatoiminnan hoidossa [ 1 ]
- Etenevät tutkimukset kilpirauhasen vajaatoimintapotilailla, jotka aloittavat L-T4-hoidon, joissa verrataan lähtötilanteen arvoja niiden välillä, jotka tulevat ja eivät tule saamaan apua LT4-monoterapiasta.
- Kokeet, joissa tutkitaan L-T4 / L-T3 -annossuhdetta, joka parhaiten vastaa seerumin FT4 / FT3-pitoisuussuhdetta terveillä koehenkilöillä.
- Satunnaistetut kliiniset tutkimukset, joissa verrataan L-T4 + L-T3-yhdistelmähoitoa ja L-T4-monoterapiaa kilpirauhasen vajaatoimintapotilailla, joilla on pysyviä oireita ja / tai jotka kantavat polymorfismeja kilpirauhashormonin kuljettajaproteiineissa ja dejodinaaseissa.
- Tutkimukset hitaasti vapautuvalla L-T3-valmisteella.
- Etenevät tutkimukset, joissa arvioidaan L-T4 + L-T3 -yhdistelmähoidon pitkäaikaista tehokkuutta ja turvallisuutta.
Mikään näistä ehdotuksista ei ole toteutunut seitsemän vuotta myöhemmin, kesäkuussa 2019
Mitkä ovat tämän aiheen tulevaisuuden tutkimusalueet?
Sen jälkeen, kun ETA:n hoitosuositus julkaistiin vuonna 2012, monet T4 + T3-yhdistelmähoitoa koskevat kysymykset ovat selventyneet. Tyypin 2 dejodinaasin SNP:ien (kuten Thr92Ala) oletetun roolin selvittämisessä on tapahtunut paljon edistystä, mutta vielä on epäselvää, miksi jotkut L-T4-potilaat kokevat pysyviä oireita normaalista seerumin TSH:sta huolimatta. Yhdistelmähoidon kiistanalainen rooli voidaan mielestäni ratkaista vain tekemällä paljon enemmän kliinisiä tutkimuksia. On vakava asia, että toistaiseksi yhtäkään vuoden 2012 hoitosuosituksessa ehdotetuista tutkimuksista ei ole toteutettu (Taulukko 5). Tämä on vielä huolestuttavampaa siksi, että tyytymättömyys hoidon tuloksiin kasvaa, ja kliininen ongelma on nyt saanut poliittisia sävyjä. Kliinisestä tutkimuksesta tulee hankalampaa, kun mukana on politiikka.
Eettisten normien noudattaminen
Eturistiriidat Kirjoittaja ilmoittaa, ettei hänellä ole mitään eturistiriitaa.
Eettinen hyväksyntä Tämä artikkeli ei sisällä kirjoittajan suorittamia tutkimuksia ihmisillä.
Tietoinen suostumus Tämä artikkeli on katsaus kirjallisuudessa julkaistuihin artikkeleihin. Katso alkuperäiset artikkelit, jos haluat tietoja osallistujien tietoisesta suostumuksesta aikaisempiin tutkimuksiin.
Kustantajan huomautus: Springer Nature on edelleen puolueeton julkaistuissa kartoissa esitettyjen lainkäyttövaltuuksien ja institutionaalisten yhteyksien suhteen.
Avoin saatavuus Tämä artikkeli on jaettu Creative Commons Attribution 4.0 -lisenssin kansainvälisellä lisenssillä ( http: // creativecommons.org/licenses/by/4.0/ ), joka sallii rajoittamattoman käytön, jakelun ja jäljentämisen mihin tahansa mediaan, mikäli annat asianmukaisen hyvityksen alkuperäiselle tekijälle ja lähteelle, jos annat linkin Creative Commons-lisenssiin ja ilmoitat, onko muutoksia tehty.
Lähteet
- WM Wiersinga, L. Duntas, V. Fadeyev, B. Nygaard, MP Vanderpump, 2012 ETA guidelines: the use of L-T4+L-T3 in the treatment of hypothyroidism. Eur. Thyroid J. 1, 55–71 (2012)
- P. Saravanan, W.-F. Chau, N. Roberts, K. Vedhara, R. Greenwood, C.M. Dayan, Psychological well-being in patients on ‘adequate’ doses of L-thyroxine: results of a large, controlled community-based questionnaire study. Clin. Endocrinol. 57,577-585 (2002)
- E.M. Wekking, B.C. Appelhof, E. Fliers, A.H. Schene, T. Huyser,J.G.P. Tijssen, W.M. Wiersinga, Cognitive functioning and wellbeing in euthyroid patients on thyroxine replacement therapy for primary hypothyroidism. Eur. J. Endocrinol. 153, 747-753 (2005)
- V. Panicker, J. Evans, T. Bjoro, B.O. Asvold, C.M. Dayan, O. Bjerkeset, A paradoxical difference in relationship between anxiety, depression and thyroid function in subjects on and not on T4: findings from the HUNT study. Clin. Endocrinol. 71, 574-580 (2009)
- SJ Peterson, AR Cappola, MR Castro, CM Dayan, APFarwell, JV Hennessey et ai. An online survey of hypothyroid patients demonstrates prominent dissatisfaction. Kilpirauhanen 28, 707-721 (2018)
- P.N. Taylor, A. Iqbal, C. Minassian, A. Sayers, M.S. Draman, R.Greenwood et al. Falling threshold for treatment of borderline elevated thyrotropin levels—balancing benefits and risks: evidence from a large community-based study. JAMA Intern. Med. 174, 32-39 (2014)
- D.J. Stott, N. Rodondi, P.,M. Kearney, I. Ford, R.G.J. Westendorp, S.P. Mooijaart et al. Thyroid hormone therapy for older adults with subclinical hypothyroidism. N. Engl. J. Med. 376, 2534-2544 (2017)
- M. Feller, M. Snel, E. Moutzouri, D.C. Bauer, M. de Montmollin,D. Aujesky et al. Association of thyroid hormone therapy with quality of life and thyroid-related symptoms in patients with subclinical hypothyroidism: a systematic review and metaanalysis. JAMA 320, 1349-1359 (2018)
- R.P. Peeters, Subclinical hypothyroidism. N. Engl. J. Med. 376, 2556-25655 (2017)
- R. Dew, K. King, O.E. Okosieme, S. Pearce, G. Donovan, P.N.Taylor et al. towards treatment of hypothyroidism in general practice: an in-depth qualitative interview study. BJGP Open 1, bjgopen17X100977 (2017). https://doi.org/10.3399/bjgopen17X10097
- R. Dew, K. King, O.E. Okosieme, S.H. Pearce, G. Donovan, P.N.Taylor et al. Attitudes and perceptions of health professionals towards management of hypothyroidism in general practice: a qualitative interview study. BMJ Open 8, e019970 (2018). https: // doi.org/10.1136/bmjopen-2017-019970
- K. Boelaert, PR Newby, MJ Simmonds, RL Holder, JD CarrSmith, JM Heward et al. Prevalence and relative risk of other autoimmune diseases in subjects with autoimmune thyroid disease. Am. J. Med. 123, 183.e1-183.e9 (2010)
- I. Guldvog, L.C. Reitsma, L. Johnsen, A. Lauzike, C. Gibbs, E.Carlsen et al. Thyroidectomy versus medical management for euthyroid patients with Hashimoto disease and persisting symptoms. A randomized trial. Ann. Int. Med. (2019). https://doi.org/ 10.7326 / M18-0284 Med. (2019). https://doi.org/ 10.7326 / M18-0284
- S.J. Peterson, E.A. McAninch, A.C. Bianco, Is a normal TSH synonymous with “euthyroidism” in levothyroxine monotherapy? J. Clin. Endocrinol. Metab. 101, 4694-4973 (2016)
- D. Gullo, A. Latina, F. Frasca, R. LeMoli, G. Pellegritti, R. Vigneriet al. Levothyroxine monotherapy cannot guarantee euthyroidism in all athyreotic patients. PLOS ONE 6, e22552 (2011)
- J.P. Walsh, L.C. Ward, V. Burke, C.I. Bhagat, L. Shiels, D.Henley et al. Small changes in thyroxine dosage do not produce measurable changes in hypothyroid symptoms, wellbeing, or quality-in-life: results of a double-blind, randomized clinical trial. J. Clin. Endocrinol. Metab. 91, 2624-2630 (2006)
- M.H. Samuels, I. Kollobova, M. Niederhausen, J.S. Janowsky, K.G. Schuff, Effects of altering levothyroxine (L-T4) doses on quality of life, mood, and cognition in L-T4 treated subjects. J. Clin. Endocrinol. Metab. 103, 1997-2008 (2018)
- M.H. Samuels, I. Kolobova, M. Niederhausen, J.Q. Purnell, K.G. Schuff, Effects of altering levothyroxine dose on energy expenditure and body composition in subjects treated with LT4. J. Clin. Endocrinol. Metab. 103, 4163-4175 (2018)
- M. Ito, A. Miyauchi, S. Morita, T. Kudo, E. Nishihara, M. Kihara et al. TSH-suppressive doses of levothyroxine are required to achieve preoperative native serum triiodothyronine levels in patients who have undergone total thyroidectomy. Eur. J. Endocrinol. 167, 373-378 (2012)
- D. Strich, C. Chay, G. Karavani, S. Edri, D. Gillis, Levothyroxine therapy achieves physiological FT3/FT4 ratios at higher than normal TSH levels: a novel justification for T3 supplementation? Horm. Metab. Res. 50, 827-831 (2018)
- B. Gereben, E.A. McAninch, M.O. Ribeiro, A.C. Bianco, Scopeand limitations of iodothyronine deiodinases in hypothyroidism. Nat. Rev. Endocrinol. 11, 642-652 (2015)
- J.P. Werneck de Castro, T.L. Fonseca, C.B. Ueta, E.A. McAninch,S. Abdalla, G. Wittmann et al. Differences in hypothalamic type 2 deiodinase ubiquitination explain localized sensitivity to thyroxine. J. Clin. Investig. 125, 769-781 (2015)
- M. Ito, A. Miyauchi, M. Hisakado, W. Yoshioka, A. Ide, T. Kudo et al. Biochemical markers reflecting thyroid function in athyreotic patients on levothyroxine monotherapy. Thyroid 27, 484–490 (2017)
- E.A. McAninch, K.B. Rajan, C.H. Miller, A.C. Bianco, Systemic thyroid hormone status during levothyroxine therapy in hypothyroidism: a systematic review and meta-analysis. J. Clin. Endocrinol. Metab. 103, 4533-4542 (2018)
- R. Hoermann, J.E. Midgley, R. Larisch, J.W. Dietrich, Is pituitary TSH an adequate measure of thyroid hormone-controlled homeostasis during thyroxine treatment? Eur. J. Endocrinol. 168, 271-280 (2013)
- V. Panicker, P. Saravanan, B. Vaidya, J. Evans, A.T. Hattersley,T.M. Frayling, C.M. Dayan, Common variation in the DIO2 gene predicts baseline psychological well-being and response to combination thyroxine plus triiodothyronine therapy in hypothyroid patients. J. Clin. Endocrinol. Metab. 94, 1623-1629 (2009)
- M.G. Castagna, M. Dentice, S. Cantara, R. Ambrosio, F. Maino,T. Porcelli et al. DIO2 Thr92Ala reduces deiodinase-2 activity and serum-T3 levels in thyroid-deficient patients. J. Clin. Endocrinol. Metab. 102, 1623-1630 (2017)
- M. Medici, L. Chaker, R.P. Peeters, A step forward in understanding the relevance of genetic variation in type 2 deiodinase. J. Clin. Endocrinol. Metab. 102, 1775-1778 (2017)
- H.J.C.M. Wouters, H.C.M. van Loon, M.M. van der Klauw, M.F. Elderson, S.N. Slagter, A. Muller Kobold et al. No effect of the Thr92Ala polymorphism of deiodinase-2 on thyroid hormone parameters, health-related quality of life, and cognitive functioning in a large population-based cohort study. Thyroid 27, 147–155 (2017)
- E.A. McAninch, S. Jo, N.Z. Preite, E. Farkas, P. Mohacsik, C.Fekete et al. Prevalent polymorphism in thyroid hormone-activating enzyme leaves a genetic fingerprint that underlies associated clinical syndromes. J. Clin. Endocrinol. Metab. 100, 920-933 (2015)
- S. Jo, T.L. Fonseca, B.M.L.C. Bocco, G.W. Fernandes, E.A.McAninch, A.P. Bolin et al. Type 2 deiodinase polymorphism causes ER stress and hypothyroidism in the brain. J. Clin. Investig. 129, 230-245 (2019)
- H.B. Burch, K.D. Burman, D.S. Cooper, J.V. Hennessey, A2013 survey of clinical practice patterns in the management of primary hypothyroidism. J. Clin. Endocrinol. Metab. 99, 2077-2085 (2014)
- J. Kaminski, F.Y. Miasaki, G. Paz-Filho, H. Graf, G.A. de Carvalho, Treatment of hypothyroidism with levothyroxine plus liothyronine: a randomized, double-blind, crossover study. Arch. Endocrinol. Metab. 60, 562-572 (2016)
- R. Hoermann, J.E.M. Midgley, R. Larisch, J.W. Dietrich, Lessons from randomised clinical trials for triiodothyronine treatment of hypothyroidism: have they achieved their objectives? J. Thyroid Res. (2018). https://doi.org/10.1155/2018/3239197
- A. Carlé, J. Faber, R. Steffensen, P. Laurberg, B. Nygaard,Hypothyroid patients encoding combined MCT10 and DIO2 gene polymorphisms may prefer L-T3+L-T4 combination treatment data using a blind, randomized clinical study. Eur. Thyroid J. 6, 143–151 (2017)
- L.F. Michaelsson, J.L. la Cour, B.B. Medici, T. Watt, J. Faber, B.Nygaard, Levothyroxine/liothyronine combination therapy and quality of life: is it all about weight loss? Eur. Thyroid J. 7, 243–250 (2018)
- J.V. Hennessey, R. Espaillat, Current evidence for the treatment of hypothyroidism with levothyroxine/levotriiodothyronine combination therapy versus levothyroxine monotherapy. Int. J. Clin. Pract. 72, e13062 (2018)
- G.P. Leese, E. Soto-Pedre, L.A. Donnelly, Liothyronine use in a17 year observational population-based study – the TEARS study. Clin. Endocrinol. 85, 918-925 (2016)
- J. Jonklaas, E. Tefera, N. Shara, Physician choice of hypothyroidism therapy: influence of patient characteristics. Thyroid 28, 1416–1424 (2018)
- J. Jonklaas, E. Tefera, N. Shara, Physician choice of hypothyroidism therapy: influence of patient characteristics. Thyroid 29, 44–52 (2019)
- L.F. Michaelsson, B.B. Medici, J.L. la Cour, C. Selmer, M. Roder,H. Perrild et al. Treating hypothyroidism with thyroxine/triiodothyronine combination therapy in Denmark: following guidelines or following trends?. Eur. Thyroid J. 4, 174–180 (2015)
- B.B. Medici, B. Nygaard, J.L. la Cour, M.K. Grand, V. Siersma,D.R. Nicolaisdottir et al. Changes in prescription routines for treating hypothyroidism between 2001 and 2015 – an observational study of 929,684 primary care patients in Copenhagen. Thyroid 29 (2019). https://doi.org/10.1089/thy.2018.0539
- F.S. Celi, M. Zemskova, J.D. Linderman, N.I. Babar, M.C.Skarulis, W. Csako et al. The pharmacodynamics equivalence of levothyroxine and liothyronine: a randomized, double blind, cross-over study in thyroidectomized patients. Clin. Endocrinol. 72, 709-715 (2010)
- C. Dayan, V. Panicker, Management of hypothyroidism with combination thyroxine (T4) and triiodothyronine (T3) hormone replacement in clinical practice: a review of suggested guidance. Thyroid Res. 11 (2018). https://doi.org/10.1186/s13044-018-0045-x
- B.B. Medici, J.L. la Cour, L.F. Michaelsson, J.O. Faber, B. Nygaard. Neither baseline nor changes in serum triiodothyronine during levothyroxine/liothyronine combination therapy predict a positive response to this treatment modality in hypothyroid patients with persistent symptoms. Eur. Thyroid J. 6, 89–93 (2017)
- J. Jonklaas, K.D. Burman, H. Wang, K. Latham, Single dose T3 administration: kinetics and effects on biochemical and physiologic parameters. Ther. Drug Monit. 37, 110-118 (2015)
- J. Jonklaas, K.D. Burman, Daily administration of short-acting liothyronine is associated with significant triiodothyronine excursions and fails to alter thyroid-responsive parameters. Thyroid 26, 770–778 (2016)
- F. Santini, M. Giannetti, I. Ricco, G. Querci, G. Saponati, D.Bokor et al. Steady-state serum T3 concentrations for 48 h following the oral administration of a single dose of 3,5,3’-triiodothyronine sulfate (T3S). Endocr. Pract. 20, 680-689 (2014)
- P.N. Taylor, S. Razvi, I. Muller, J. Wass, C.M. Dayan, K. Chatterjee, K. Boelaert, Liothyronine cost and prescriptions in England. Lancet Diab Endocrinol. 7, 11-12 (2019)
- https://hansard.parliament.uk/Lords/2018-06-20/debates/5A689F14-D2F8-4796-8732-CBD0E3B3E508/BrandedHealthServiceMedicines(Costs)Regulations2018
- T.D. Hoang, C.H. Olsen, V.Q. Mai, P.W. Clyde, M.K. Shakir,desiccated thyroid extract compared with levothyroxine in the treatment of hypothyroidism: a randomized, double-blind, crossover study. J. Clin. Endocrinol. Metab. 98, 1982-1990 (2013)
Emeritusprofessori Wiersingasta:
https://www.emedevents.com/speaker-profile/wilmar-m-wiersinga
Tämä käännös on tarjottu Suomen kilpirauhaspotilaat ry:lle. Se ei heille kelvannut.
Tanskalaiset tutkivat geenimuunnoksia
Vaikka Suomen endokrinologiyhdistys mitätöi geenivirheiden aiheuttamat ongelmat kilpirauhasen vajaatoiminnan hoidossa, muualla ollaan niistä kiinnostuneita. Erilaisia geenivirheitä löydetään jatkuvasti lisää.
Myöskään DIO2-geenipolymorfismimäärityksen avulla ei ole mahdollista arvioida höytyisikö potilas Thyroxin-hoidon sijasta trijodityroniinihoidosta (T3-hoito, kauppanimellä Liothyronin ja Thybon).
ThyroidUK on listannut niitä sivustollaan, ja niitä on varmasti löydetty sen jälkeen lisää. Yhdelle geenivirheelle on jo saatavissa kaupallinen testi.
Vasta ilmestyneessä tanskalaistutkimuksessa tutkittiin muutamaa geenimuunnosta ja niiden yhdistelmiä. Tutkimusjoukko koostui 45 selvästi autoimmuunista vajaatoimintapotilaasta. Mukana tutkijoissa oli Euroopan suosituksia valmistellut endokrinologian ylilääkäri Birte Nygaard.
Hypothyroid Patients Encoding Combined MCT10 and DIO2 Gene Polymorphisms May Prefer L-T3 + L-T4 Combination Treatment – Data Using a Blind, Randomized, Clinical Study
Carlé A.a · Faber J.c,d · Steffensen R.b · Laurberg P.a · Nygaard B.c,d
Tutkimusjoukko koostui Hashimoton autoimmuunitulehdusta sairastavista kilpirauhasen vajaatoimintapotilaista, jotka olivat olleet tyroksiinihoidolla 6 kuukautta, ja heidän kilpirauhasarvonsa olivat olleet viitealueella. Kyseessä oli etenevä kaksoissokkotutkimus.
Joukko jaettiin kahtia. Toinen ryhmä jatkoi 3 kk tyroksiinihoidolla, toisella ryhmällä korvattiin 50 µg tyroksiinia 20 µg:lla liotyroniinia (T3). TSH:n säädöt tehtiin tyroksiinilla. 3 kk kuluttua vaihdettiin lääkitystä siten, että tyroksiiniryhmälle annettiin yhdistelmälääkitys ja yhdistelmälääkityille tyroksiinia.
Tutkimuksen aikana seurattiin eri geenimuunnoksia: 3 muunnosta DIO2-geenissä ja yhtä kuljetusproteiinin MCT10 muunnosta. Puolen vuoden tutkimuksen jälkeen kysyttiin potilailta, kumpaa lääkitystä he pitivät parempana.
27/45 (60 %) potilasta piti yhdistelmää parempana.
Tutkijat yhdistivät kaksi geenimuunnosta, DIO2-geenin Thr92Ala (se, jota saa testata yleisesti) ja kuljetusproteiinigeenin MCT10 muunnoksen rs17606253, ja saivat aikaan kolme ryhmää: potilaat joilla ei ollut kumpaakaan, ne joilla oli toinen muunnos ja ne joilla oli molemmat. Näissä ryhmissä yhdistelmää piti parempana 42 %, 63 % ja 100 %.
Johtopäätöksenä tutkijat sanovat, että yhdistelmäterapiaa saatetaan tulevaisuudessa käyttää tiettyjä geenimuunnoksia omaaville potilaille.
Vieraskirjoitus: Raskaana olevat kilpirauhasen vajaatoimintapotilaat eivät saa välttämätöntä T3-hormonia
Miten moni lapsi on asetettava vaaraan T3-puutoksen aiheuttamille vaurioille, ennenkuin raskaana olevien vajaatoimintapotilaiden hoitosuositukset alkavat soveltaa olemassa olevia tutkimustuloksia?
© thyroidhormones.wordpress.com
Raskaana olevien hypotyreoosipotilaiden hoitosuositus tuntee vain yhden kilpirauhasen tuottamista monesta hormonista, T4:n, synteettisessä muodossa Thyroxin. Syyksi ilmoitetaan, ettei kilpirauhashormoni T3 kuitenkaan läpäisisi istukkaa.
Esim. ruotsalaisella nettisivustolla Internetmedicin, jonne moni menee lukemaan asiantuntijoiden kirjoituksia, annetaan hoito-ohjeita ja tietoa osiossa ”Kilpirauhanen ja raskaus”:
”Vain T4 läpäisee istukan, ei T3, sen vuoksi yhdistelmähoidolla Liothyronin ja T4 olevien potilaiden tulee siirtyä T4-monoterapiaan raskauden ajaksi.”
Hoito Liothyroninilla: Yhdistelmähoidolla liotyroniini (T3) ja levotyroksiini (T4) olevat naiset on mahdollisuuksien mukaan hoidettava pelkällä levotyroksiinilla ennen raskautta. Syy tähän on, että T3, toisin kuin T4, ei läpäise istukkaa. Mikäli ei ole mahdollista luopua Liothyroninista, on huolehdittava riittävän korkeista, eli odottavien äitien viitealueella olevista T4-V-tasoista.”
Internetmedicin, 31. tammikuuta 2017
Mutta tämä ei pidä paikkaansa. T3 läpäisee istukan. Ja tämä on ollut tiedossa yli 60 vuoden ajan.
Kelly Landersin ja Kerry Richardin julkaisussa ”Traversing barriers – How thyroid hormones pass placental, blood-brain and blood-cerebrospinal fluid barriers” lehdessä Molecular and Cellular Endocrinology, kerrotaan yhteenvetona miten tieto istukan läpäisemistä kilpirauhashormoneista on lisääntynyt ajan kuluessa (1).
Kirjoituksesta käy ilmi, että jo 1960-luvun alussa oli osoitettu radiojodin avulla, että sekä T3 että T4 siirtyvät äidistä sikiöön. Näihin aikoihin mm. Fisher ym. osoitti tämän vuonna 1964 julkaistussa tutkimuksessa, ja huomauttivat myös että T3 siirtyy istukan läpi koko raskausajan ja myös suuremmassa määrin kuin T4 (2).
”Moreover, in humans triiodothyronine 131I has been observed to pass from the mother to the fetus more readily than thyroxine at all stages of pregnancy (4,7*).”
Fisher et al, 1964*
Landersin ja Richardin artikkelista käy myös ilmi, että 80-luvun alussa, kun oli havaittu D3-entsyymin korkeaa aktiviteettiä istukassa, oletettiin ettei kilpirauhashormoni T3 läpäise istukkakudosta. D3 on dejodinaasientsyymi joka muuttaa T4:n ”epäaktiiviseksi” T3:ksi (rT3) sekä T3:n T2:ksi. Mutta teoria siitä, että D3 ”suojaisi” kilpirauhashormonien siirtymiseltä osoittautui vääräksi saman vuosikymmenen lopulla, kun oli havaittu kiertäviä kilpirauhashormoneja sikiöillä, joiden oma kilpirauhastuotanto ei ollut mahdollista.
1990-luvun alkupuolelta alkaen on myös löydetty istukan kilpirauhashormonien läpäisyn kuljetusmekanismi. Kuljetus tapahtuu kalvoihin sitoutuneiden kuljettajaproteiinien avulla. Näistä MCT8 on spesifinen kilpirauhashormonien T3 ja T4 kuljettamiselle istukkaan, ja näyttää siltä että molemmat hormonit kulkevat sen läpi yhtä suuressa määrin. Muita kalvoihin sitoutuneita kilpirauhashormonien istukan kautta kuljettavia kuljettajaproteiineja ovat LAT1, LAT2, OATP1A2, OATP4A1 ja MCT10. Edelleen uskotaan niitä löydettävän lisää.
Tätä ”uutta” havaintoa että T3 läpäisee istukan, vastoin asiantuntijoiden lausumia, tulee jokaisen miettiä tarkemmin.
T3 tarvitaan, jotta naiset voisivat tulla raskaaksi, jotta raskaudet sujuisivat normaalisti, ja turvaamaan sikiön normaalin kehityksen ja erityisesti aivojen kehityksen, sillä T3 säätää mm. aivosolujen kehitystä, erikoistumista ja signalointia.
Pelkkä oletus, kuten nyt tehdään, että T4-monoterapia tuottaa vereen ja kudoksiin normaalin T3-pitoisuuden, on asia jota tieteellinen tutkimus ei koskaan ole kyennyt osoittamaan.
Miten monen lapsen, jolla on mahdollisesti T3:n puutos ja sen mukana hidastunut kehitys ja pahimmassa tapauksessa korjaamattomat vauriot, on vielä synnyttävä, ennenkuin kukaan uskaltaa kyseenalaistaa suosituksen, jonka mukaan raskaana olevat naiset eivät saa käyttää T3:a?
Voimme vain toivoa, että asiantuntijoiden suosituksiinsa käyttämä ajatuksenkulku, että ”T3:a ei tule käyttää, koska se ei läpäise istukkaa”, päivitetään ja että tunnustetaan olemassa oleva tieteellinen tutkimus ja sen mukana aletaan antaa raskaana oleville naisille yhdistelmähoitoa T3 + T4.
Kirjoittanut: Nina Oksa nina.oksa@gmail.com
Alkuperäinen ruotsinkielinen teksti: https://thyroidhormones.wordpress.com/2017/04/27/gravida-hypotyreospatienter-far-inte-det-nodvandiga-hormonet-t3/
© thyroidhormones.wordpress.com
FAKTAA
T3:a (trijodityroniini) on lääkkeessä Liothyronin, jota yli 8000 ruotsalaispotilasta käyttää. Ruotsissa Liothyronin on tavallinen reseptilääke.
T3:a on myös kuivatusta kilpirauhasuutteesta valmistetuissa lääkkeissä, jotka ovat erityisluvallisia. Kuivatusta kilpirauhasuutteesta valmistetuissa lääkkeissä, jotka usein lyhennetään NDT (natural desiccated thyroid), on mukana kaikki terveen kilpirauhasen erittämät kilpirauhashormonit. Näiden valmisteiden hormonipitoisuudet ovat lähes identtiset terveen ihmisen veren hormonipitoisuuksien kanssa. Näitä lääkkeitä on käytetty 1800-luvun lopulta asti, ja Ruotsissa niistä on raportoitu vain muutama haittavaikutus vuodesta 1965.
ATA:n suosituksissa vuodelta 2017 lukee, että T3 läpäisee istukan:
”Thyroid stimulating antibodies, ATDs, and most maternal thyroid hormones, can effectively cross the placenta barrier.”
2017 Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum
Viitteet:
- Landers K, Richard K. Traversing barriers – How thyroid hormones pass placental, blood-brain and blood-cerebrospinal fluid barriers. Mol Cell Endocrinol. 2017 Jan 30. pii: S0303-7207(17)30054-0. doi: 10.1016/j.mce.2017.01.041. PMID: 28153799
- Fisher DA, Lehman, Lackey C. Placental Transport of Thyroxine. J Clin Endocrinol Metab. 1964 May;24:393-400. No abstract available. PMID: 14169496
* Viitteitä Fisherin et al tutkimuksesta vuodelta 1964 (numerointi Fisheristä)
- Grumbach MM, Werner SC.Transfer of thyroid hormone across the human placenta at term. J Clin Endocrinol Metab. 1956 Oct;16(10):1392-5. No abstract available. PMID: 13367179
- Osorio C, Myant NB. The passage of thyroid hormone from mother to foetus and its relation to foetal development. Br Med Bull. 1960 May;16:159-64. No abstract available. PMID: 14429249
John Midgleyn teesit skoteille
Muutama vuosi sitten kolme kilpirauhaspotilasta sai läpi aloitteen Skotlantin parlamentille, jossa vaadittiin parempaa diagnosointia ja hoitoa kilpirauhaspotilaille. Parlamentin aloitevaliokunta on käsitellyt asiaa pitkään ja hartaasti, kuullut eri tahoja ja on nyt halunnut kuulla saksalais-britannialaisessa tutkijaryhmässä vaikuttavaa John Midgleytä. Tutkijaryhmä on viime vuosina julkaissut ahkerasti kilpirauhashormonitoiminnan uraauurtavia selvityksiä.
Skotlannin parlamentin aloitevaliokunta sai äskettäin kirjeen tri Midgleyltä. Hänen mielestään pitää mahdollisimman nopeasti ryhtyä toimenpiteisiin, tässä järjestyksessä:
1. Alentaa Britannian huippukalliin T3:n hintaa (monopoli) ja kirjoittaa eläinperäisiä kilpirauhaslääkkeitä kaikille sitä tarvitseville.
2. Tarkistaa eri valmistajien laboratoriomenetelmien yhtenevyys ja tarvittaessa kalibroida ne niin, että ne kaikki näyttävät samaa ja oikein.
3. Korvata TSH-mittaus T3-V-mittauksella, paitsi vakavasti sairailla, joilla on NTI (Non Thyroidal Illness), eli alhainen T3-V ja korkea rT3.
4. Laskea TSH:n viitealueen ylärajaa kuvastamaan oikeasti terveiden arvoja ja soveltaa uutta ylärajaa.
5. Nostaa potilaan oireet pääosaan ja käyttää laboratorioarvoja vain niitä tukemaan.
6. Valistaa lääkäreitä tilastomatematiikan merkityksestä, eli että viitealueet ovat tilastollisia arvoja, eivätkä mitään maalitolppia joiden sisäpuolelle pitää pyrkiä.
7. Mitata kaikilta terveiltä T4-V ja T3-V, ja arkistoida tulokset henkilökohtaisina arvoina (tosin T4-V ei mahdollisesti kelpaa tähän tarkoitukseen). Näin olisi jokaisen henkilökohtainen paras arvo tallessa myöhempää tarvetta varten.
8. Laskea jokaiselle suhdeluku T4-V/T3-V ja käyttää sitä mahdollisen myöhemmän lääkityksen määrittämiseen.
9. Suorittaa kunnolla suunniteltuja kokeita määrittämään potilaiden hyöty yhdistelmäterapiasta, eteisvärinän ja osteoporoosin todennäköisyys, jakamalla potilaat terapioille perustuen yllä laskettuun suhdelukuun T4-V/T3-V. Mitä korkeampi suhdeluku, sitä todennäköisemmin potilas hyötyy yhdistelmäterapiasta, ja sitä epätodennäköisemmin hyvin matala TSH indikoi liikalääkitystä.
Uudet tutkimukset saattavat vaikuttaa kilpirauhasen vajaatoiminnan hoitosuosituksiin
Yhdysvaltain hoitosuosituksia laatimassa ollut professori Antonio Bianco ja apulaisprofessori Elizabeth McAninch julkaisivat tämän kirjoituksen toukokuussa 2016.
Kilpirauhanen tuottaa hormoneja, mm. T4 (hyvin matala aktiivisuus) ja T3 (aktiivisin). Aivolisäke seuraa jatkuvasti verenkierrossa kiertäviä T4- ja T3-tasoja, ja erittää TSH:ta aina kun jomman kumman hormonin taso putoaa alle tietyn kynnyksen. Kilpirauhasen vajaatoiminta on tila, jossa kilpirauhanen ei toimi riittävästi johtuen inflammaatiosta (Hashimoton kilpirauhastulehdus), leikkauksesta tai muusta syystä. Useimmilta potilailta tämä diagnosoidaan veren kohonneen TSH-pitoisuuden perusteella.
Ensi näkemällä kilpirauhasen vajaatoiminnan hoito näyttää suoraviivaiselta: Annetaan päivittäinen annos tyroksiinia tabletteina. Tätä suositellaan usein. Tämän ”monoterapian” (vain yksi lääke käytössä) ajatellaan toimivan seuraavasti: (1) suurin osa kilpirauhasen tuottamasta hormonista on T4:ää ja (2) suurin osa kiertävästä T3:sta on tuotettu kilpirauhasen ulkopuolella dejodinoimalla T4:ää, eli poistamalla yksi jodiatomi T4-molekyylistä, jotta saadaan T3-molekyyli. T4-monoterapian päätavoite on normalisoida seerumin TSH-taso, jolloin odotetaan T3-tason normalisoituvan itsekseen. Useimmat vajaatoimintapotilaat vastaavat hyvin tähän lääkitykseen.
Tosin noin 10 – 15 %:lla potilaista tämä toimintatapa ei poista kaikkia vajaatoiminnan oireita, vaikka TSH ja T4-V olisivatkin viitealueella. Tämä ilmiö on havaittu siitä lähtien, kun tyroksiinista tuli kilpirauhasen vajaatoiminnan vakiohoito, eli noin 40 vuotta sitten, ja sitä on ollut vaikea jättää huomioimatta. On totta, että monet kilpirauhasen vajaatoiminnan oireet, kuten matala energiataso, hidas aineenvaihdunta ja väsymys, on myös usein havaittu muissa tiloissa, esimerkiksi naisten vaihdevuosien aikana. Myös masennusta esiintyy usein väestössä, ja se voi johtaa samankaltaisiin oireisiin. Siksi useimmat oppineet ovat olettaneet että vajaatoiminnan jatkuvat oireet eivät välttämättä johdu tyroksiinimonoterapian toimimattomuudesta, vaan ne ovat muiden, yleisten sairauksien aiheuttamia sekoittavia tekijöitä.
Kliinisen näytön perusteella kaikki parametrit eivät normalisoidu niillä potilailla, joita hoidetaan tyroksiinikorvaushoidolla. Kun kiertävä TSH on saatu viitteisiin, veren T4-tasot vakiintuvat suhteellisesti korkeammalle tasolle, kun taas T3 vakiintuu suhteellisesti alemmalle tasolle. Tosiasiassa noin 15 %:lla tyroksiinimonoterapialla hoidetuista potilaista T3-tasot jäävät viitealueen alapuolelle. Tiedämme nyt, että muunto T4:stä T3:een on tehokkaampaa aivoissa ja aivolisäkkeessä kuin muissa T3:a verenkiertoon tuottavissa kudoksissa. Sen takia TSH saadaan normalisoitumaan suhteellisen korkeille T4- ja suhteellisen matalille T3-tasoille.
Voiko tämä seerumin T3-tason suhteellinen väheneminen olla kliinisesti tärkeää? Toisin sanoin, onko tämä syy siihen, miksi osa tyroksiinilla hoidetuista potilaista jää oireiseksi, vaikka heillä on TSH viitealueella? Vaikka tätä ei ole selkeästi osoitettu olemassaolevissa kliinisissä kokeissa, tähän kysymykseen on helppo vastata KYLLÄ, koska T3 on biologisesti aktiivinen kilpirauhashormoni. Rottakokeiden esikliiniset tiedot tukevat hypoteesia, että normaalien T3-tasojen saavuttaminen seerumissa voi olla tärkeää kilpirauhasen vajaatoiminnan hoidossa. On olemassa selkeitä, mitattavissa olevia merkkejä kilpirauhashormonien puutteesta monissa kudoksissa, kuten aivoissa, maksassa ja luurankolihaksissa, jotka jäävät jäljelle rotissa, joiden kilpirauhanen on poistettu ja joita on hoidettu tyroksiinimonoterapialla. On huomattavaa, että nämä kudosmarkkerit normalisoituvat rotilla liotyroniinilisällä, T3-lääkkeellä, yhdistelmähoidolla (tyroksiini + liotyroniini). Tätä hoitoa on tutkittu myös kliinisissä tutkimuksissa, mutta useimmat tutkimukset eivät ole paljastaneet suuria eroavaisuuksia tuloksissa. Tietenkään ihmisellä tehtävät kokeet eivät ole yhtä suoraviivaisia kuin jyrsijöillä, koska emme rutiininomaisesti pysty hankkimaan kudoksia tutkittavaksi kilpirauhashormonien puutteen toteamiseksi, ja siten useimmat tutkimukset nojaavat potilaiden subjektiivisiin mielipiteisiin.
Muut tekijät saattavat vaikuttaa potilaiden vasteeseen tyroksiinihoitoon. On tunnistettu suhteellisen yleinen geenimuunnos tyypin 2 dejodinaasissa, joka johtaa yksittäisen aminohapon muutokseen dejodinaasiproteiinin kriittisessä silmukassa. Eräässä kliinisessä kokeessa ainoastaan sellaiset vajaatoimintapotilaat, joilla oli tämä geenimuunnos, kokivat myönteisiä tuloksia yhdistelmähoidolla. Vaikka tarvitaankin lisää tutkimuksia, jotta voisimme ymmärtää tämän geenimuunnoksen vaikutuksia, on mahdollista että tämä geneettinen tekijä ohjaa kykyämme päätellä, ketkä potilaat voisivat hyötyä yhdistelmähoidosta kilpirauhasen vajaatoiminnan hoidossa.
Professorit: Tyroksiini ei todellakaan auta kaikkia vajaatoimintapotilaita
Tunnettu endokrinologian professori Antonio Bianco, joka on ollut mukana laatimassa Yhdysvaltain uusimpia kilpirauhasen vajaatoiminnan hoitosuosituksia vuonna 2014, ja jolla on oma tutkimuskeskus Chicagossa, on yhdessä apulaisprofessori Elizabeth McAninchin kanssa kirjoittanut artikkelin uusimpaan Lancet Diabetes & Endocrinologyyn, jossa hän kertoo miten tyroksiiniin aikanaan päädyttiin, ja että se ei auta kaikkia kilpirauhasen vajaatoimintapotilaita.
http://www.thelancet.com/journals/landia/article/PIIS2213-8587%2815%2900325-3/fulltext
Before 1970, the predominant treatment for hypothyroidism was desiccated thyroid, typically porcine, given at doses to resolve symptoms and normalise the basal metabolic rate and serum protein-bound iodine concentration. Thyrotoxic side-effects were not uncommon, but were remediable by dose reduction; patients with residual hypothyroid symptoms were not routinely reported. Although the efficacy of desiccated thyroid was inconsistent and the costs of levothyroxine had fallen, desiccated thyroid remained the preferred agent because concerns had arisen that levothyroxine monotherapy resulted in a relative T3 deficiency.
Ennen vuotta 1970 yleisin kilpirauhasen vajaatoimintaan käytetty hoito oli kuivatusta sian kilpirauhasesta valmistettuja tabletteja, joita annettiin sellaisina annoksina, jotka poistivat oireet ja normalisoivat perusaineenvaihdunnan ja siihen aikaan mitatun proteiiniin sitoutuneen jodin pitoisuuden. Tyreotoksikoosi (kilpirauhashormonimyrkytys) ei ollut tavaton, mutta se pystyttiin hoitamaan vähentämällä annosta. Potilaita, joille jäi vajaatoimintaoireita, ei raportoitu rutiininomaisesti. Vaikka eläinperäisen lääkkeen vaikutus vaihteli ja levotyroksiinin hinta oli pudonnut, eläinperäisiä lääkkeitä käytettiin edelleen mieluummin kuin levotyroksiinia, koska oli herännyt huoli siitä, että tyroksiinimonoterapia johti suhteelliseen T3-hormonin puutteeseen.
In the 1970s, the therapeutic approach changed after the development of the serum thyroid-stimulating hormone (TSH) radioimmunoassay, which showed that typical doses (200–400 μg per day of levothyroxine) were supratherapeutic, and the discovery that most circulating T3 is derived via extrathyroidal conversion of T4. From that point on, normalisation of serum TSH has become the treatment target to avoid the deleterious effects of iatrogenic thyrotoxicosis on the skeleton and heart, doses of levothyroxine have been substantially decreased, and levothyroxine monotherapy has become the preferred treatment in view of its excellent safety profile. Today, most patients do well with levothyroxine monotherapy, establishing normalisation of serum TSH concentrations and symptomatic remission. It is widely accepted that levothyroxine restores the T4 pool and deiodinases regulate peripheral T3 production.
1970-luvulla hoitosuunta muuttui, kun oli kehitetty TSH-tutkimusmenetelmä, joka osoitti että tyypilliset tyroksiiniannokset (200 – 400 µg/vrk) olivat liian suuria, ja oli saatu selville että suurin osa kiertävästä T3:sta muuntuu kilpirauhasen ulkopuolella T4:stä. Sen jälkeen TSH:n normalisointi on ollut hoidon tavoite, jotta vältettäisiin vahingossa syntyneen tyreotoksikoosin haitalliset vaikutukset luustoon ja sydämeen. Tyroksiiniannoksia on myös olennaisesti pienennetty, ja tyroksiinimonoterapiasta on tullut suosituin hoitomuoto sen erinomaisen turvallisuusprofiilin takia. Tällä hetkellä useimmat potilaat voivat hyvin tyroksiinimonoterapialla, heidän TSH-arvonsa on normaali ja oireet ovat poistuneet. On yleisesti hyväksytty ajatusmalli, jonka mukaan tyroksiini palauttaa T4-varannot ja dejodinaasit säätävät perifeeristä T3-tuotantoa.
However, after this transition, some patients given levothyroxine (about 12%) were reported to have residual symptoms of hypothyroidism. Although psychological issues could have been coexisting in these patients, this finding suggests that adoption of this supposedly physiologically sensible regimen has set the scene for a new category of so-called euthyroid patients—ie, those given levothyroxine who have normal serum TSH but residual symptoms of hypothyroidism. In fact, other markers of thyroid hormone economy might not be fully normalised in patients given levothyroxine; the basal metabolic rate can remain subnormal, lipid abnormalities can persist, and the serum T4:T3 ratio is raised, with relatively lower serum T3 concentrations. Notably, less attention has been given to the raised T4:T3 ratio because serum TSH dominates as the therapeutic target and the medical community has dogmatic confidence in the deiodinases to appropriately regulate tissue T3 generation.
Tyroksiiniin siirtymisen jälkeen raportoitiin kuitenkin että eräät potilaat (noin 12 %) kärsivät edelleen vajaatoimintaoireista. Vaikka psykologiset ongelmat voivat olla myös läsnä näissä potilaissa, tämä löydös osoittaa että uuden hoitotavan myötä on syntynyt uusi potilasryhmä, ns. eutyreoottiset potilaat, eli ne tyroksiinia käyttävät potilaat joiden TSH on viitteissä mutta joilla on edelleen vajaatoimintaoireita. Itse asiassa muut kilpirauhashormonitalouden markkerit eivät ehkä ole normaaleja tyroksiinia käyttävillä potilailla: perusaineenvaihdunta saattaa pysyä liian alhaisena, veren rasva-arvot saattavat edelleen olla epänormaalit, ja seerumin T4:T3-suhde on koholla, kun T3-pitoisuus on suhteessa liian alhainen. On huomattavaa, ettei kohonneeseen T4:T3-suhteeseen ole kiinnitetty huomiota, koska TSH dominoi hoitoa ja lääketiedeyhteisöllä on opinkappaleena luottamus siihen, että dejodinaasit aina säätävät kudosten T3-tasot asianmukaisiksi.
———-
Available clinical evidence suggests that levothyroxine monotherapy does not represent a universally adequate replacement for thyroid function. The rationale underlying the transition to this strategy in the 1970s was not necessarily flawed—levothyroxine provided a safe, consistent dose and the clinical sequelae of the rise in T4:T3 ratio were not understood. Now that the mechanism underlying the inability of levothyroxine monotherapy to universally normalise serum T3 in patients with normal serum TSH concentrations is understood, it is important that future investigations into the clinical significance of a low serum T3 concentration or high T4:T3 ratio are done. High-quality randomised controlled clinical trials are also justified to assess whether patients with the Thr92Ala D2 polymorphism have a unique response to combination therapy. With continued investigations and evolving clinical insight, we hope that treatment strategies will be devised to help all patients achieve clinical and biochemical euthyroidism.
Saatavissa oleva kliininen näyttö osoittaa, ettei tyroksiinimonoterapia edusta yleisesti riittävää korvaushoitoa kilpirauhastoiminnalle. Ajatustapa tyroksiiniin siirtymiselle 1970-luvulla ei välttämättä ollut virheellinen. Levotyroksiini tarjosi turvallisen, tasaisen annoksen ja eikä T4:T3-suhteen nousun kliinisiä vaikutuksia ymmärretty. Nyt kun ymmärretään mekanismi , minkä takia tyroksiini ei kykene yleisesti normalisoimaan seerumin T3-tasoja potilailla joiden TSH on viitteissä, on tärkeää että tulevaisuudessa tutkitaan, mitkä ovat matalan T3-pitoisuuden tai korkean T4:T3-suhteen kliiniset vaikutukset. Laadukkaita, satunnaistettuja kliinisiä tutkimuksia tarvitaan arvioimaan, onko Thr92Ala D2-geenimuunnoksen omaavien potilaiden vaste yhdistelmäterapialle ainutlaatuinen. Toivomme että jatkuvilla tutkimuksilla ja niistä syntyvällä kliinisellä ymmärtämyksellä kehitetään hoitostrategioita niin, että kaikki potilaat saavuttavat kliinisen ja biokemiallisen eutyreoosin.
Kilpirauhasen vajaatoiminnan hoitotilanne Suomessa
Eräiden lähteiden mukaan (Suomen Kilpirauhasliitto, lääkäri Ulla Slama) Suomessa noin 400 – 500 000 ihmistä sairastaa kilpirauhasen vajaatoimintaa. Heistä noin 300 000 on diagnosoitu ja he ovat saaneet lääkityksen. Tilanne muistuttaa 2-tyypin diabeetikkojen tilannetta. Saldo: 100 – 200 000 diagnosoimatonta potilasta. Heitä saatetaan roikottaa ”seurannassa” arvot viitteiden rajoilla jopa toistakymmentä vuotta. Myös aivolisäkeperäinen (sentraalinen) vajaatoiminta, jossa TSH on normaali tai matala ja T4V viitteen alarajan tuntumassa, jää havaitsematta. Professori Välimäen suosituksesta huolimatta näille potilaille ei anneta edes koelääkitystä, saati kuunnellaan heidän oireitaan. Mitä yhteiskunnalle maksaa pitää näin monta työikäistä puolikuntoisina?
(Endokrinologien aika kuluu kasvavan diabetesepidemian hoitamiseen. Tietenkään potilaille ei saa ehdottaa kokeiltavaksi hiilihydraattien vähentämistä, sillä sehän vähentäisi kalliiden lääkkeiden ja insuliinin tarvetta ja parantaisi kuntien ja valtion rahatilannetta, kokonaan ilman yhteiskunnan korvauksia.)
Viimeaikaisten tutkimusten mukaan tyroksiinimonoterapia ei auta läheskään kaikkia sitä käyttäviä. Oireita jää, eikä veren T3V-taso saavuta terveen ihmisen tasoja. Niinpä T3V:n mittaamista ei haluta suositella. Paljonko näitä ihmisiä on, jotka tarvitsevat tyroksiinin rinnalle tai tilalle muuta kilpirauhaslääkitystä?
Professori Biancon tutkimuksissa, jotka julkaistiin tammikuun 2015 alussa, sanotaan näin:
Tutkijat arvioivat, että geenin Thr92Ala-D2 mutaatio on olemassa 12 – 36 %:lla väestöstä. Tämä yleinen mutaatio vaikeuttaa muuntoa T4:stä T3:ksi.
Suomessa mutaation esiintyvyydeksi voisi arvioida 600 000 – 1 800 000 ihmistä! Ja jos heille puhkeaa vajaatoiminta, muutkin sairausriskit kohoavat. Muunto siis tapahtuu etupäässä muualla kuin kilpirauhasessa, joten kyseessä ei ole ns. primääri (kilpirauhasperäinen) kilpirauhasen vajaatoiminta, eikä tila jää kiinni tavanomaisella TSH- ja T4V-mittauksella. Niinpä sitä ei ole olemassa suomalaisten endokrinologien mielestä. T3 (liotyroniini, trijodityroniini) on aktiivinen kilpirauhashormoni, joka ohjaa koko kehon toimintaa aineenvaihdunnasta ja aivotoiminnasta alkaen. T4 (tyroksiini) on varastohormoni.
Suomen kilpirauhaspotilaista saattaa 60 000 – 180 000 omata tämän geenimutaation, jolloin tyroksiini ei yksinään riitä hoidoksi.
Professori Bianco on erittäin arvostettu endokrinologi ja tutkija, jolla on oma tutkimuskeskus Rushin yliopistossa Chicagossa. Hän on ollut mukana laatimassa Yhdysvaltain kilpirauhasen vajaatoiminnan hoitosuosituksia.
Biancon tutkimusryhmän raportissa sanotaan myös:
Ainoastaan yhdistelmäterapia T4 + T3 normalisoi täysin T3:sta riippuvat metaboliset markkerit ja geenien ilmenemisen. Nämä löydökset saattavat tukea yhdistelmäterapian käyttöä kilpirauhasen vajaatoimintapotilailla, ja saattavat johtaa tarpeeseen kehittää parempia farmakologisia malleja T3:n määräämiselle ja suorittaa laadukkaita satunnaistettuja tutkimuksia ihmisillä.
Uudet tutkimukset haastavat oppilauseen, jonka mukaan T4-altistuksesta johtuva alentunut D2-aktiivisuus kompensoituu lisääntyneellä raaka-aineen saatavuudella, mikä pitää ennallaan tai jopa lisää T3-tuotantoa. Vaikka tämä ajatus on looginen, se vaatii kokeita jokaiselle D2:ta ilmentävälle kudostyypille erikseen, koska koko kehon T3-tuotanto D2-reitin kautta vähenee kohonneen T4/T3-suhteen takia.
Välttämällä liian suurta T4/T3-suhdetta käyttämällä hitaasti liukenevia, ihonalaisia T4 ja T3 sisältäviä pellettejä yhdistelmähoitona pystyttiin normalisoimaan kilpirauhashormoneista riippuvat biologiset parametrit aivoissa, maksassa ja luurankolihaksissa.
Japanilaistutkimuksen mukaan noin 26 prosentille tutkituista vajaatoimintapotilaista ilmaantui vasta-aineita dejodinaasi2-entsyymiä kohtaan.
Tämä tarkoittaisi Suomessa 104 000 – 130 000 potilasta, joille pelkkä tyroksiini ei auta.
Yhdysvalloissa rekisteröitiin eläinperäisille kilpirauhaslääkkeille siirtyneiden tyytyväisyyttä. Kaikista potilaista noin kolmasosa oli siirtynyt eläinperäiselle, ja heistä 78 % oli tyytyväisiä vaihtoon. Kaikista potilaista heitä oli 26,7 %.
Suomeen käännettynä lukumäärä voisi olla 106 800 – 133 500 potilasta.
Birte Nygaard on tanskalainen endokrinologian ylilääkäri, joka on ollut mukana laatimassa eurooppalaisia hoitosuosituksia. Hän julkaisi tutkimusryhmineen kaksi tutkimusta vuosina 2009 – 2013. Tutkimusryhmä kirjoitti:
Aktiivisten kilpirauhashormonien (pääasiassa T3) saatavuus on monimutkainen prosessi. Nämä hormonit pääsevät kudoksiin verenkierron, aktiivisen kalvon läpi kuljetuksen, solun sisäisen säätelyn, kolmen aktiivisen dejodinaasin avulla (tyypit 1 ja 2 muuntavat T4 > T3, tyyppi 3 epäaktiiviseksi rT3:ksi) ja lopuksi sitoutumalla erityisiin soluytimien kilpirauhashormonireseptoreihin. Eri kudoksilla on erilaiset metaboliset kulkureitit, mikä tekee todellisen kaikkien kilpirauhashormonien vaikutuksen määrittämisen tietylle kudokselle tiettynä ajankohtana vaikeaksi.
Mittaustietomme paljasti että niin SHBG kuin PINP lisääntyivät yhdistelmäterapialla verrattuna tyroksiinihoitoon. NT-proBNP ei muuttunut. Näistä voi päätellä että yhdistelmäterapialla on suurempi vaikutus maksan toimintaan ja luun muodostukseen kuin tyroksiinimonoterapialla, ja näin ollen solujen sisäiseen kilpirauhashormonien saatavuuteen.
Tämä koskee siis kaikkia kilpirauhaspotilaita…
Mikä onkaan perimmäinen syy, miksi näitä tietoja ei haluta ottaa huomioon, eikä kertoa yleisemmin lääkäreille ja potilaille?
Millä resursseilla voitaisiin hoitaa potilaita oikein, yhdistelmäterapialla tai T3-monoterapialla, jos kerran endokrinologit ja sisätautilääkärit ovat täysin kiinni 2-tyypin diabeetikkojen hoidossa? He, joiden monopoliksi nyt yritetään saada yhdistelmähoitoa?



