Ilta-Sanomat kirjoitti kilpirauhasen vajaatoiminnasta
Nyt tuli tietoon taas uusi lääkäri, jonka luokse ei kannata mennä, jos on hiemankin hankala kilpirauhasen vajaatoiminta. Tämä lääkäri oikoo mutkat suoriksi. Artikkeli on otsikon Moninaiset alla. Minusta se on väärä paikka.
https://www.is.fi/menaiset/hyva-fiilis/art-2000009189764.html
Finnradio.fm käsitteli kilpirauhaskiistaa (11.07.2018)
Aurinkorannikon Finnradio.fm innostui kilpirauhaskiistasta.
Edellisen viikon keskiviikkona 4.7.2018 heillä oli aiheesta tunnin lähetys, jossa oli haastateltavina lääkäri Pentti Raaste, Kilpirauhasliiton toiminnanjohtaja Asta Tirronen ja lääkäri Ville Pöntynen.
Aiheesta nousi keskusteluryöppy, joten ohjelma jatkui 11.7. taas tunnin ohjelmalla. Tällä kertaa oli mukana potilas Katariina Roine-Heikkala ja Suomen kilpirauhaspotilaat ry:n puheenjohtaja Marianne Kuokkanen.
Ilmeisesti radioasema aikoo jatkaa aiheen käsittelyä tulevissa ohjelmissaan.
Tämän päivän 11.07.2018 ohjelmatiedot
Katariina Roine-Heikkalan tarina
Marianne Kuokkanen pienen välipuheen jälkeen
Toimittajien loppukeskustelu
Viime viikon ohjelmatiedot
Pentti Raaste
Asta Tirronen
Ville Pöntynen
Puheenjohtaja Marianne Kuokkasen haastattelun kirjoitti auki Merja Haapala.
Katariina Roine-Heikkalan haastattelun kirjoitti auki Tuija Leino.
Suomen kilpirauhaspotilaat ry:n puheenjohtaja Marianne Kuokkanen Finnradio.fm:n haastateltavana 11.7. 2018
Marcos: Minulla on nyt täällä puhelimen päässä Marianne Kuokkanen Suomen kilpirauhaspotilaat ry:stä, terve!
Marianne: Terve!
Marcos: Täällä Suomessa velloo nyt iso keskustelu tästä kilpirauhashoidosta ja se on itse asiassa vellonut jo useita vuosia. Miten näet tämän tilanteen kilpirauhaspotilaat ry toiminnan kautta?
Marianne: Tilannehan on huono, uskotaan että pelkkä tyroksiini auttaa kaikkia. Kuitenkin hyvin monet potilaat voi sillä huonosti. Eri lähteiden mukaan 15-38 % potilaista ei pärjää tyroksiinilla, tämä on siis tutkimustietoa. Koska Suomessa on 330 000 lääkkeen käyttäjää, niin tämä tarkoittaisi noin 125 000 potilasta enintään.
Marcos: Okei, valtava määrä siis. Mikä on tämä teidän roolinne tässä osassa kilpirauhaspotilaat, että mitä palveluja te teette tässä sairauden yhteydessä?
Marianne: No meitä on siis joukko, joka perusti tämän yhdistyksen kolme vuotta sitten ja Kilpon eli kilpirauhaspotilaat ry:n ajatus on edistää sitä että jokainen kilpirauhaspotilas saisi häntä auttavaa lääkehoitoa. Ja me levitetään sitten tästä johtuen tietoa uusista tutkimustuloksista kaikille, jotka haluavat niistä tietää. Elikkä me levitetään sitä julkisesti meidän nettisivujen kautta. Lisäksi me pidetään esillä sitä, että potilaat saa epätasa-arvoista kohtelua Suomessa. Eri sairaanhoitopiireissä toimitaan eri tavalla. Esimerkiksi otetaan eri laboratoriokokeita diagnosointivaiheessa. Me jaetaan meidän jäsenille tietoa myös muista laillisista lääkkeistä kuin tyroksiinista. Tämä ei ole mitään tuotemarkkinointia, vaan tämä tapahtuu nimenomaan kemiallisten nimien perusteella. Sitten yritämme saada tiedotusvälineet, lääkärikunnan ja yleisön ymmärtämään, mikä ero on erityisluvallisilla, virallisilla lääkevalmisteilla ja niin sanotuilla vaihtoehtohoidoilla. Lisäksi me annetaan vertaistukea meidän jäsenille omassa keskusteluryhmässä. Ja siellä jaetaan hiljaista tietoa tilanteesta.
Marcos: Joo, eli siitä on muodostunut tärkeä tukiverkosto myös potilaille jotka eivät ole kokeneet saaneensa apua perusterveydenhuollossa.
Marianne: Kyllä
Marcos: Miten te näkisitte, että tätä tilannetta pitäisi voida ratkaista. Onko sulla jotain näkemystä potilaiden kautta syntynyt, että mitä keinoja tässä nyt pitäisi saada aikaan, jotta tämä asia edistyisi?
Marianne: No ensinnäkin pitäisi kuunnella potilaita. Ja Suomen endokrinologiyhdistys joka on tässä paljon vartijana, niin niiden pitäisi seurata uusimpia tutkimuksia, ja Valviran pitäisi noudattaa lakia ja nousta hoitokiistan yläpuolelle. Viittaan tähän lääkäri Ville Pöntysen julkituomaan toimintaan.
Marcos: Aivan, se on hyvin erikoinen episodi kyllä kerta kaikkiaan.
Marianne: Ja sitten tosiaan, potilaiden oireet pitäisi ottaa huomioon. Aina pitäisi ottaa myös kilpirauhashormonit, eikä vaan tätä aivolisäkehormonia kun diagnosoidaan ja hoidetaan. Ja sitten erityisesti T3-V, joka on epäsuosiossa, eli vapaa T3, aktiivinen kilpirauhashormoni, niin se pitää ottaa laboratorioiden ohjeiden mukaan aamulla ennen lääkkeenottoa. Ei niin kuin nyt halutaan tehdä, eli kaksi tuntia lääkkeen jälkeen, ja sitten siihen sovelletaan kuitenkin lääkkeettömän tilanteen viiterajoja.
Marcos: Okei, täähän kuulostaa erittäin erikoiselta, eli tällainenkö suositus on tällä hetkellä voimassa?
Marianne: Ei ole suositusta, mutta endokrinologit tekee tätä.
Marcos. Ahaa, okei, erittäin mielenkiintoista tietoa. Varmaan potilaat pystyy tästä aika paljon keräämään sitä tietoa myös taustalla?
Marianne: Potilaathan keskustelee keskenään. Ja sitten tämä, että kilpirauhasen vasta-aineita on useita, mutta yleisin on TPO-vasta-aine, ja se pitäisi ottaa paljon useammin kuin nyt tehdää, koska se osoittaa autoimmuunitulehduksen melkein kaikissa tapauksissa. Autoimmuunitulehdus, jossa keho hyökkää omaa kudostaan vastaan, niin se aiheuttaa noin 90 % kaikista vajaatoimintatapauksista.
Marcos: Onko teillä minkäännäköistä keskusteluyhteyttä tämän endokrinologien kanssa tai Valviran kanssa? Onko syntynyt mitään keskusteluyhteyttä näiden viranomaisten kanssa?
Marianne: Endokrinologiyhdistys on yhdistys ja he eivät vastaa meidän viesteihin. Valvirassa on käyty delegaatiolla puhumassa ja sovittu asioita. Se on niin kuin vesi hanhen selästä.
Marcos: Joo-o, ja Valviran ylijohtajana jatkaa Markus Henriksson vuoden 2019 loppuun saakka. Olet kirjoittanut hänestä jo useampi vuosi sitten ja kun luin tämän kirjoittamasi artikkelin Turun sanomissa niin näyttää siltä, että paljon ei ole tapahtunut näiden vuosien välillä. Onko siellä jarrutusta sitten tämän asian suhteen, vai miksi nämä asiat eivät mielestäsi etene?
Marianne: Mehän ei varsinaisesti voida osoittaa yhtään mitään, mutta todella ei mene eteenpäin. Saatetaan luvata jotain, mutta sitten tehdäänkin jotain aivan muuta. Valvirahan muuttuu sitten Luovaksi.
Marcos: Jaha, joo-o, millä tavalla luovaksi? (naurua)
Marianne: Uuden organisaation nimi on Luova ja siellä on Valvira ja kaikennäköisiä muitakin instansseja sitten yhdisteltynä.
Marcos: Mutta ei välttämättä ole sitten luova edelleenkään näissä asioissa. Se hämmästyttää, että kun tähän on perehdytty ja meillä (radiossa) tämä keskustelu on ollut erittäin, erittäin vastaanotettu ja kommentoitu ja näyttää että tässä on erittäin suuri pullonkaula koko hoidon takana, niin tulee väistämättä mieleen, että millainen näppituntuma sinulla on, miksi tämä on niin vaikeaa siellä Suomessa?
Marianne: Epäilen, että kyseessä voisi olla arvovaltakiista.
Marcos: Joo, tää tuntuu olevan aika merkittävä. Tää tulee niin monelta suunnalta, että onko se Valviran vai endokrinologiyhdistyksen vai kenen mielestäsi tämä arvovalta tässä on kysymyksessä?
Marianne: Endokrinologit. Mutta sitten toisaalta Valvirahan ei pidä potilaita asianosaisina, elikkä kun ne rupeaa tarkastelemaan jonkun lääkärin toimintaa niin ne pyytää sieltä potilasasiakirjat itselleen ja sitten ne potilasasiakirjat kiertelee tuolla asiantuntijoilla. Mutta potilailta itseltään ei haluta tietää yhtään mitään.
Marcos: Eli onko tässä samanlainen kummallisuus Suomessa mikä sotii aika paljon yleistä oikeustajua vastaan, eli vakuutuslääkäritoiminta, mikä on aivan omaa ihmeellisyysluokkaansa? Eli siinä voidaan tehdä päätöksiä selvittämättä, kysymättä millään tavalla siltä potilaalta joka on oikeasti se tärkein koko terveydenhuollossa?
Marianne: Joo kyllä, potilaalla ei ole tässä mitään roolia. Potilaiden päiden yli puhutaan tässäkin.
Marcos: Erittäin, erittäin mielenkiintoista että se on tällaista. Mutta mitä tälle voidaan tehdä? Onko teillä mitään sellaista suunnitelmaa tai muuta vai onko se vain sitä, että kun yritetään vaikuttaa näihin ministereihin ja asianosaisiin? Eikö ulkomaiset tutkimustulokset millään tavalla vaikuta suomalaisiin päättäjiin?
Marianne: No en tiedä, kilpirauhaspotilaat ovat joutuneet itse kaivamaan tietoja koska tuntuu ettei kukaan muu sitä tee potilaiden puolesta. Eli potilaiden on ollut pakko perehtyä tähän omaan hoitoonsa niin syvällisesti. Ja niinpä kilpirauhaspotilaat ry:kin hankkiutui kontaktiin kansainvälisesti tunnetun tutkijaprofessori Hoermannin kanssa. Ja olemme saaneet sitten häneltä kommentteja näihin suomalaisten endokrinologien kirjoituksiin. Niitä on julkaistu Kilpon nettisivuilla.
Marcos: Mites sitten suomalaispotilaat, joutuvatko he hakemaan nyt apua ulkomailta, esimerkiksi täältä Espanjasta, jossa ei ole samanlaista ajojahtia mitä siellä Suomessa. Joutuuko suomalaiset potilaat nyt turvautumaan muihin keinoihin sitten saadakseen hoitoa, jonka he kokevat auttavan heitä?
Marianne: No siis ne potilaat, joilla on kielitaitoa ja kuntoa, niin ne lähtee ulkomaille, jos Suomesta ei löydy lääkäriä tai lääkkeitä. Eli pitkin Eurooppaa kuljetaan etsimässä lääkäriä, apteekkia ja lääkkeitä. Nämä erityisluvalliset lääkkeet on erityisluvallisia Suomessa sen takia, että lääkeyritykset eivät ole katsoneet taloudellisesti kannattavaksi hakea myyntilupaa, koska markkinat on liian pienet. Mutta ne on sitten muualla, monessa maassa tavallisia reseptilääkkeitä tai peräti reseptivapaita lääkkeitä. Mutta toisaalta Suomeen täytyy sitten tullin takia olla resepti, kun tuo maahan jotakin lääkettä.
Marcos: Kyllä aiheuttaa aika kummallisen tilanteen koko terveyshuoltohoito, soteuudistukset, kaikki puhuttavat Suomea niin näyttää että siellä on muitakin aukkoja kuin pelkästään tää koko suunnitelma. Kyllähän se on kummallinen tilanne, jos suomalaiset joutuvat hakemaan sitten apua ulkomailtakin, myös omiin terveydellisiin ongelmiinsa.
Marianne: Kaikkein kamalinta on sitten se, että kaikki ei ymmärrä, että he voisivat voida paremmin, ja ne jotka ymmärtää, mutta ei ole kielitaitoa eikä kuntoa, niin ne joutuu sitten kärsimään kotona.
Marcos: Aivan, mielenkiintoista tässä on, että eikö yleensä lääketiede ole sellainen, jossa haetaan uutta tietoa, miten potilaita voidaan hoitaa. Ja näin ulkopuolisena toimittajana, mitä me täällä tarkastellaan, näyttää eriskummalliselta, että jos löytyy tapoja joilla potilaat voi paremmin, niin eiköhän niitä pitäisi tutkia eikä estää? Joku kummallisuus tässä piilee, vai mitä mieltä tästä olet Marianne?
Marianne: Yleisesti ottaen lääkäreiden mielestä tämä on helppo sairaus, otetaan vaan tyroksiininappi aamulla ja kaikki on hyvin.
Marcos: Yhym, mielenkiintoista, hmm, mutta me jäämme tässä nyt sitten katsomaan miten tämä asia etenee, ja te olette jo pitkään tehneet tällaista tärkeää työtä ja toimineet potilaiden vertaisverkostona, ja ilmeisesti tämä työ tulee vaatimaan vielä panostusta että se saataisiin eteenpäin. Millaiset tulevaisuusnäkymät teillä on nyt täällä kilpirauhaspotilasliitossa?
Marianne: Me ei olla liitto vaan yhdistys (naurua). Mehän tietenkin toivottaisiin, että terveyskeskuksissa olisi lääkäreitä, jotka osaisivat tätä sairautta hoitaa myös silloin, kun se muuttuu vähän mutkikkaammaksi, että kaikki saisi sitä kautta oikeat lääkkeet itselleen.
Marcos: Aivan, kiitos tästä haastattelusta Marianne Kuokkanen Suomen kilpirauhaspotilaat ry:stä!
Marianne: Kiitos!
Katariina Roine-Heikkalan haastattelu 11.7.2018
Marcos (M), Katariina (K)
M: Minulla on nyt puhelimen päässä Katariina Roine-Heikkala. Terve, mitä sinulle kuuluu tänään?
K: Terve! Kiitos! Tänne Suomeen kuuluu oikein hyvää ja työpäivä takana ja kesäilta ihana kesäilta täällä Suomessa, että hyvin pyyhkii!
M: Missäs päin Suomea sä olet?
K: Mä oon Pirkanmaalla Tampereella.
M: Aivan. Ja mä soitan sulle ihan sen takia, että Suomea kuohuttaa hyvin paljon tämä kilpirauhassairauksien ongelma ja kaikki mitä siihen tällä hetkellä tuntuu liittyvän. Niin jos mä sitten ihan kysyn sulta, että milloin sulla on tämä sairaus todettu?
K: Aa, kuule se vie sitte ajassa taaksepäin yhdeksänkytluvulle eli yhdeksänkytneljä sitä alettiin epäillä ja yhdeksänkytviis mä oon saannu siihen sen tavanomaisen lääkityksen tyroksiinin.
M: Aivan oikein. Millaisia ongelmia tää sairaus on sulle tuonut mukanaan, että millasia oireita siinä oli ennen kuin se sitten purettiin ja löydettiin, että sinulla on tämä sairaus?
K: No, kyl se niinkö näky siinä ihan alkuvaiheessa semmosena absoluuttisena väsymyksenä. Et, mun silloinen poikaystävä, nykyinen mieheni, niin ihmetteli suunnattomasti, miten mä voin vaan nukkua. Koko ajan vaan nukkua, ja sit mä menin lääkäriin ja lääkäri otatutti sitten erinäisen määrän verikokeita, missä oli sit nää kilpparikokeet. Ja tota, siitä se sitten lähti ja sisätautilääkärillä mä siinä sitten kerkesin ensimmäiset vuodet olla…
M: Joo-o
K: …hoidossa. Et siinä se lähinnä mulla niinko oli, mutta sitten oireet pahentui vuosien myötä.
M: Okei. Millaista se hoito oli sulla pääasiassa siinä alkuvaiheessa, että millaista hoitoa sait?
K: No, se oli siinä vaiheessa, niinko puhuttiin tällaisesta helposta sairaudesta, ja kerran päivässä nappi naamaan niin homma on hanskassa. Näin se oliki aluks.
M: Okei, Mitä sitten tapahtui?
K: No vuosien myötä tilanne paheni ja se tarkoitti sit sitä, että, että mmm, mulla alko muisti pettään, mun kuulo huononi, mulle tuli roskan tunne silmään, mun iho alko kukkia niin paljon, et mä en oo siis edes teinivuosina, ikinä mul ei oo ollu finnejä niin paljon.
M: Oho!
K: Jaa, ja mä lihoin ihan hirveesti. Ja se varmaan niinkon sitten riittikin, että, et ja sit se väsymys, mikä siinä koko ajan on taustalla, kun lääkitys ei pure.
M: Aivan. Mitä, miten lääkärit tähän reagoi siihen aikaan? Että, tulkittiinko se silloin jo tähän kilpirauhasongelmaan vai miten se sun taudinkuva sitten eteni lääkäreiden mielestä?
K: No silloin yhdeksänkytluvun sit siit puolivälistä, oliskohan pari – kolme vuotta, mä olin sen sisätautilääkärin hoidossa, mut sitten mä tavallaan jouduin vähän niinku hunningolle. Mua ei hoitanut kukaan. Ja mä vaan kävin uusin reseptit ja mua ei tavallaan tavannut oikeastaan kukaan tämän asian tiimoilta. Jaa, ja sit työterveydessä niitä sitten, että ruvettiin enemmän penkoon kun päästiin 2003-vuoden lopulle, mulla alko tulla kurkkukipua, tosi kovaa kurkkukipua, ja sitä lähdettiin ensin hoitaa antibiooteilla. Taisin saada kuus eri antibioottikuuria ennenku uskottiin, et tää ei ehkä oo angiina. Ja tota sit lähettiin tutkii vasta paremmin ja 2004 mulla sitten todettiin, et mul on kasvain kilpirauhasessa ja tota sitte 2004 kesällä oli sitte operaation aika. Ja tota lääkäri, leikkaavalle lääkärille ei mennyt tietoa et mulla on tämmönen ku vajaatoiminta. Onneksi tapasin tämän leikkaavan kirurgin ennen, kun leikattiin ja mä sanoin tästä, ja hän päätti poistaa koko kilpirauhasen.
M: Okei.
K: Siinä vaiheessa olin tietysti onnessani, että, että tulipa, tulipa hoidettuina ne hommat kuntoon, mut sitte ku tuli patologin vastaus niin sitten ei enää ollutkaan riemu kohillaan eli just se puoli, mikä meinattiin jättää, niin sielt löytyy pahalaatuinen syöpä.
M: Okei.
K: Ja operaation jälkeen jatkettiin tyroksiinihoitoo ja sit siitä se alamäki lähti.
M: Ahaa. Okei. Eli tää ei tavallaan tullu siitä kuntoon. Et miten perehtyikö ne lääkärit? Oliko siellä jotain erikoislääkäreitä tällä alalla, jotka tutki vai oliko se semmosta, että jouduit juoksee useammalla vai oletko – miten se toimi, se sun hoito?
K: Siinä on, ainakin silloin oli 2004, tämmönen standardi proseduuri täällä Pirkanmaalla, et tälläsen totaalipoiston jälkeen mentiin radiojodihoitoon, olisko pari kuukautta leikkauksesta, ja kävin sitte siellä, näytti ihan hyvältä vielä siinä vaiheessa, mut sitte kun pelkällä tyroksiinilla yrittää lääkitä, lääkitä itsensä ja korvata sillä ne moninaiset hormonit, mitä kilpirauhanen erittää, niin mun kohdalla tulos oli kyl miinusmerkkinen.
M: Okei. Mites, mites…
K: Jaa, ja niin, ja sit ei nyt hirveesti lekuriapuja siinä vaiheessakaan tullut, muuta kuin sitä et syöpäkontrolli.
M: Joo. Mites sitten, sitten, onko tähän löytynyt mitään apua, apukeinoa sun ongelmaan, sairauden hoitamiseen.
K: Joo, sitten niinkö et aikani ja vuosia asiaa kypsyttelin niin taisin päästä sitten lopulta työterveyden kautta Tampereen kaupungin alaisen klinikan kautta hoitoon, joka nyt erityisesti ei ollut tarkoitettu kilpparipotilaille, mutta endokrinologi otti siellä vastaan ja tuota siitä sitten syntyi tämmönen ihan hyvä, hyvä hoitosuhde, mutta että vallitsevat käytänteet oli sellaiset, että hän ei ainakaan ensalkuun isommin innostunut tästä T3-hoidosta mitä mä kyselin perään ja sitä mä sain anella aika pitkään ennen kun lähettiin ees kokeileen. Et – sit me elettiin jo, varmaan 2000… oisko 7? 8? -vuotta…
M: Joo-o
K: …ennenku tää kokeilu aloitettiin. Hetkellinen hyöty sitten siitäkin, mut sitte taas se Thyroxin rupes aiheuttaan ongelmia.
M: Oliko – mistä sä löysit tämmösen mahdollisuuden, jota sinä siis itse tarjosit lääkärille, että saisit tällaista hoitoa? Että hankitko sä jostain tietoa tai oliko sulla joku vertaisverkosto tai joku, josta sä tätä informaatiota sitten sait siihen aikaan?
K: Siinä vaiheessa mä tutustuin asiaan vielä ihan itekseni. Olin aika neuvoton, ja tota tosiaan kyl mä kauheesti olisin siinä vaiheessa jo tarvinnu vertaistukea, mutta oli vähän no-can-do. Mä en osannut etsiä sitä.
M: Aa-ha. Okei. No on varmaan aika kysyä sinulta, että miten sinun hoitosi on tänä päivänä järjestetty ja miten se toimii sinulle?
K: No, nyt täytyy mennä vielä hiukan ajasta taaksepäin eli sillon kun sitten tää tämmönen ensimmäinen yhdistelmähoito sen tyroksiinin ja lion kanssa alkoi, ja sitte ku se alamäki alkoi senkin kanssa, niin mä epätoivoisena otin myös yhteyttä lääkevalmistajaan sen tyroksiinin osalta ja kyselin niinko, et minkäaikaistutkimuksia heillä ylipäätään koko lääkkest on ja tota niitä ei oo minkäänlaisia, et se on kiireellä aikanaan tuotettu markkinoille ja tota mä tajusin heti, että no mä nyt sitten vaan on se, jolle se ei yksinkertaisesti käy. Kiva jos jollekin käy, mut mulle ei käy. Ja siitä sitten alkoikin tän mun oman endoni kanssa iso vääntö, että mä nyt sitten lopulta vajaa pari vuot sitte sain tän paljon puhutun eläinperäisen ja plus tän Liothyronin-lääkityksen, että sitten on alkanut elämä palailemaan pikkuhiljaa raiteilleen. Et nyt voin sanoo että iho ei kuki enää, mä kuulen paremmin, mulla ei oo enää roskan tunnetta silmässä, mä jopa muistan asiota, mun työt sujuu ja mä pystyn elämään suht koht normaalia elämää ja tänään viimeks, kun mä kävin kosmetologillakin, niin minkä kanssa mulla on myös pitkäaikainen hoitosuhde, niin kyllä hän sanoi, että jotain kummallista tässä kahden vuoden aikana on tapahtunu, että ei olla kyllä sellaisissa ihon kukkimistilanteissa, kuin sillon joskus, että naiselle sekin on tärkee juttu, mutta että mun mielestä isoin asia on se, että aika hyvin tavoiteltu jo sitä hyvää elämänlaatua, mitä nyt jokaisella normaalilla ihmisellä pitäis olla.
M: Nyt on varmaan hyvä kysymys, että miten sinun mielestäsi Suomessa? – Eikö lääkärillä ole tietotaitoa tai osaamista sitten hoitaa esimerkiksi sinun kaltaista tapausta? Että sä oot ilmeisesti aika paljon joutunut myös selvittämään ja että vaatimaan lääkkeen saamista käyttöösi? Mikä on sinun näkemyksesi tähän?
K: No mä sanoisin, että ehdottomasti suurimman avun ikinä koskaan milloinkaan mä oon saanut tälläsestä potilasyhdistyksestä ku Suomen kilpirauhaspotilaat ry ja siellä vertaistuesta. Mä en varmaan olisi tässä tilanteessa, jos mä en neuvoja sitte sieltä olis viimeisen parin-kolmen vuoden aikana saanut – siitä iso kiitos Kilpolle! Ja tota sitten, jos puhutaan mun henkilökohtaisesta mielipiteestä ton lääkäreitten osalta niin mä sanoisin, että sairaanhoitopiirien endon ylilääkärit on aika isossa roolissa tässä, miten Suomessa kilpirauhassairauksia hoidetaan. Niihin ei ole Käypä hoito –suositusta. Niihin käytetään sitä Palveluvalikoimaneuvoston suositusta ja siitä on tehty ns. ”käypä hoito” ja tota se ei nyt ihan pelitä. Ja sitten tavallaan just tässä oppikiistassa, mikä nyt täällä Suomessa velloo aika isosti, niin mun mielestä siinä sit just se asiakas, potilas, mikskä nyt kutsutaankin – mä sanoisin asiakkaaksi – asiakas unohtuu. Ja tota silloin sä et saa hyvää asiakaspalvelua. Se ei tarkoita sitä, että pitäis mielistellä asiakasta ja tehdä sillain kuin asiakas sanoo, mutta niin kauan kun esimerkiksi Suomessa ei verenpainesairauspotilaita tai diabetespotilaita hoideta samalla lääkkeellä kaikkia niin minkä takia meitä, ja etenkin kilpparittomia, minkä takia meitä pitäisi pystyä hoitamaan yhdellä samalla lääkkeellä? En tiedä.
M: Aika mielenkiintoinen kysymys!
K: Ja tota sit toisekseen, kun just kun se kilpirauhanen erittää useita eri hormoneja terveellä ihmisellä. Minkä takia, esimerkiksi kilpirauhassairauden saaneen, tai etenkin sellaisen jollei sitä kilpirauhast ole, minkätakia meidän pitäis tyytyä tällaiseen synteettiseen T4-hormoniin? En tiedä. Ja sitten mun mielestä aika paljon näkyy tietämättömyyttä, että mä mä oon kohdannut yhden kerran terveyskeskukses lääkärin, josta mä totesin, et ei tästä tuu yhtään mitään. Et mä on opettajan roolissa, kun tavallaan hoidon pitäisi jotenkin kulkea mun mielestä vähän erilailla että ei asiakas neuvo lääkäriä.
M: Mm-m
K: Ja sitte tietysti se perustuu myös lääkiksen opetukseen. Oon kuullut, että ei siellä hirveen paljon endokrinologian osa-aluetta ja kilpirauhassairauksia käsitellä. Voin olla nykyään väärässä, mutta tämä tieto on ihan – ei kovinkaan monen vuoden takaa.
M: Aivan. Aika mielenkiintosta tää koko prosessi, mitä siellä Suomessa käydään ja nimenomaan tämä potilaan näkökulma, ainakin mitä täältä me seurataan sitä niin näyttää unohtuneen ja toit vahvasti esille sen, että se on näin. Miten sä koet tai näät nää lääkärit, jotka yrittää sitten sinunkaltaista potilasta auttaa ja heiltä viedään oikeuksia? Mikä on sun mielipide tämmöseen?
K: No se nyt on aika itsestäänselvästi se, että mä en ymmärrä, miten joku lääkärikolleega voi saada sellaiset kiksit, että käräyttelee täysin turhasta kolleegaansa, joka hoitaa hyvin, joka hoitaa asiakkaitaan hyvin, kontrolloi hyvin ja kukaan ei oo ollu minkään näköises hengenvaarassa. Ja etenkin koska puhutaan nyt ihan suoraan, että laillisella lääkkeellä hoidetaan, on se sitten tyroksiinia liotyroniinia, possulääkettä tai mitä hyvänsä, niin on Suomessa laillisia lääkkeitä. Ainoa ero on, että isoon osaan kilpparilääkkeit tarvitsee sen erityisluvan ja se on sit se vaan semmonen kupongin täyttö lääkäriltä, jonka sitten asiakas vie apteekkiin. Et tavallaan jotenkin tuntuu, et se punainen lanka on ihan hukassa useimmilla lääkäreillä, jopa alan erikoislääkäreillä.
M: Aivan. Sä herätät oikeastaan aika mielenkiintoisen ajatuksen tässä kun kuuntelen tätä sun potilaskertomusta ja taustaa. Siellä puhutaan usein lääketieteestä niin tässä kun tuntuu siltä, että sulle on kokeiltu monenlaisia asioita, jotka ei ole toiminut ja sitten kun on kokeiltu jotain, joka toimii niin se ei ookkaan hyväksyttävä. Miten se itse koet sen?
K: Kyl mä koen sen aika ahdistavana, et mun tää nykyinen hoito perustuu siihen, että mun endokrinologi on hoitanut mua nyt jo niin pitkään, et hän on nähnyt sen, kun on hoidettu sillä niin sanotulla normaalilla tavalla ja kun se ei tehoa ja sit hän näkee tämän ison muutoksen, mikä siinä tapahtuu, kun hoidetaan semmosella ei-tavanomaisella lääkkeellä, mut asiakas on huomattavasti paremmassa kunnossa.
M: Aivan.
K: Ja tota mä nään tän hirveen ongelmallisena sen takia, että mua hoidetaan tällä hetkellä TaYS:issa ja siellä nyt velloo sitten kuitenkin ilmeisesti myös vähän kaksi eri koulukuntaa. Toiset antaa näitä eläinperäisreseptejä, T3-reseptejä, toiset ei anna. Ja mä en tiedä, mihin se perustuu ja minä pelkään kovasti itekki, et mulle jo meinattiin tossa keväällä mun lääkärikontakti poikkasta mulle mitään kertomatta. Askeleelta lääkäri kontakti poikkasta mitään kertomatta ja mun endokrinologille mitään kertomatta, mutta onneks sain kiinni, koska mun oli pakko vaihtaa se päivä, milloin mulle oltiin aika varattu, mutta tosiaan aika oli jollekin ihan oudolle, uppo-oudolle lekurille ja mä pelkään pahoin, että kun syksyl pitäisi tavata uudestaan ja uusia resepti, voin olla aika isojen ongelmien edessä. En tiedä. En mä tiedä, mistä mä sitten lääkkeeni haen, mutta tyroksiinille mä en enää lähde, koska mä tuun siitä ihan tajuttoman kipeäksi.
M: Aivan. Eli tää tulevaisuus varmaan huolettaa siinä sinua myös siitä että miten tästä eteenpäin ja kuulostaa käsittämättömältä tämä potilaiden kohtelu Suomessa. Sä varmaan tiedät, että täällä Espanjassahan ei tällaista ole, eikä tämmösiä käräyttämisiä ja itse asiassa espanjalaiset lääkärit luonnehti sitä ajojahdiksi, kun me haastateltiin tämän tapauksen tai tällaisten tapausten takia täällä. Niin on se vähän erikoista tää suomalainen käytäntö ja herättää – ymmärrän, että herättää -valtavasti keskusteluja ja, ja ja näetkö sä mitään semmosii keinoja tai tapoja, joilla voisi muuttaa tätä käytäntöä? Onks sulla mitään potilaana tämmösiä näkymiä tämmösestä?
K: Mä sanon ihan suoraan ja rehellisesti, et hirveesti on tutkimusaineistoo. Mäkin oon sitä saanut nähtäväksi ja luettavaksi, että just vertaistuen kautta sielt Kilposta ja jos mä ymmärrän esimerkiksi englantia niin mä ihmettelen, minkä takia alan erikoislääkärit ei ymmärrä englantia. Et emmä tiedä, että onko joku sisälukutaito-ongelma vai mikä siinä on, mutta että kun mulle esimerkiks voi sama teksti aueta ihan eri lailla, kun miten se on sitte ehkä tulkittu jonkun erikoislääkärin toimesta. Ja sit että kyl mä kauheesti toivoisin sitä semmosta hyvää yhteistyötä. Et mä nään tässä nyt vaan oikeestaan just semmosta tietynlaista valtapeliä, hyväveliverkostoja, mä nään jopa tietynlaisen korruption piirteitä, huonoo virkakoneistoo, hirveän huonoo valvontaa. Et ihan älyttömän paljon parannettavaa on näin asiakkaan näkökulmasta katsottuna ja emmä tiedä, että sit se on aika tylyy sanoo, mut kyl mä oon tätäkin miettinyt, et halutaaks meidät jotenkin ennenaikaiseen hautaan tai jotain? Tai ollaks me jotain koekaniineita jollekin lääkefirmalle? Tälleen vähän niinku ilmaseks? Et en mä haluaisi lähteä myöskään siihen ainakaan multa lupaa kysymättä. Kyl mä ite toivoisin, että asiakkaita ja potilaita hoidettais yksilöllisesti. Me ei olla kukaan samanlaisia…
M: Aivan.
K: …Pääpirteissään voidaan olla, mut sit ku mennään tämmösiin omalaatuisiin erikoisuuksiin niinkuin vissiin minäkin jollain lailla olen, niin mua ei voi hoitaa sillai kuin jotain standardipotilasta.
M: Aivan. Eli tässä on nyt tullu erittäin merkittäviä asioita ja ollaan kuultu siis Katariina Roine-Heikkalan kertomus, potilaan kokemus, siitä, miten tämä hoito tai sairaus on edennyt ja miten häntä on hoidettu ja miten olet siis saanut apua tästä Suomessa tällä hetkellä vellovasta kiistellystä lääkkeestä, joka tuntuu olevan muualla kyllä ihan normaalissa käytössä, mutta ei Suomessa, ja me tietysti toivomme, että sieltä löytyy juuri niitä asioita, mitä otit esille eli keskustelua ja ehkä niiden, onko sitten joku arvovaltakysymys olemassa Suomessa tai mikä ihmeessä sitten onkin? Heitit aika kovia väitteitä, jotka kaikki sietäisi tehdä tutkimusta, että mikä tämän takana sitten oikein on? Eikä potilas olet tärkein?
K: Niin kyl se ainakin ittellä täs herää hirveesti semmonen kysymys, että kuka tosiaan niin kun saa tällaisesta kiksit, et näin tehdään, koska sitten, jos sama tapahtuis jollekin toiselle isolle potilasryhmälle, vaikka diabeetikoille, niin mä luulisin, että hurja älämölö olisi jo, että lopettaa tällaisen toiminnan hyvin äkkiä. Ja meitä on kuitenkin verraten melko lailla sama määrä Suomessa.
M: Aivan. Kiitoksia tästä haastattelusta Katariina, ja me toivomme, että tämä asia löytää oikeat uomansa ja potilaat saavat asiallista lääkitystä! Kiitos!
K: Kiitos teille ja ei muuta kuin oikein hyvää ja aurinkoista viikkoa sinne Espanjaan!
Testaa muuntosi, ellet voi hyvin tyroksiinilla!
Tiedätkö, että voit testata muuntosi, mikäli sinulla on samaan aikaan otetut TSH, T4-V ja T3-V, sekä niiden viiterajat?
Lääketieteellisen perustan testille löydät täältä: https://www.frontiersin.org/articles/10.3389/fendo.2016.00057/full
https://www.frontiersin.org/article/10.3389/fendo.2016.00057
Käy lataamassa koneellesi Spina-Thyr-ohjelma. http://spina.sourceforge.net/download.html
Käyttöohje englanniksi: https://sourceforge.net/projects/spina/files/Documentation/
Kun olet ladannut ohjelman ja asentanut sen koneellesi, eteesi aukeaa pääikkuna. Valitse ylävasemmalta Edit ja sieltä Preferences, niin pääset asettamaan mittayksiköt ja viitealueet.

Kun rastitat Remember-ruudun, ohjelma muistaa yksiköt. FT4 = T4-V ja FT3 = T3-V. Älä koske muihin arvoihin. Voit tallentaa laboratorioviitteet haluamaasi paikkaan napilla Save to file. Painettuasi OK pääset takaisin alkunäyttöön.
Syötä sinne mittaustulokset.
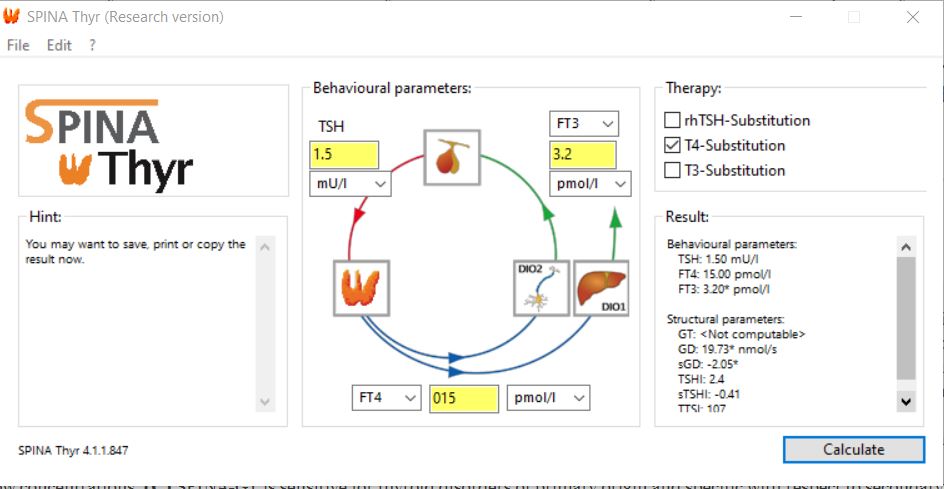
Merkitse lääkityksesi. Jos käytät tyroksiinia, rastita T4-substitution. Muuntoa ei voi laskea, jos käytät T3-lääkettä.
Klikkaa sitten Calculate (laske). Oikeaan alanurkkaan ilmestyy labratuloksiin liittyviä arvoja. GD tarkoittaa muunnon aktiivisuutta. Jos siinä näkyy tähti, se tarkoittaa ettet muunna tarpeeksi tyroksiinia T3:ksi. GT:n kohdalla lukee ”ei laskettavissa”, koska olin laittanut T4-korvaushoidon kohdalle rastin. Ilman rastia siihenkin olisi ilmaantunut laskettu arvo. Alla esimerkki:

Ohjelman kehitti endokrinologi, tohtori Johannes W. Dietrich professori Hoermannin tutkimusryhmästä.
Endokrinologien tiedettä
Lähes kaikissa kilpirauhasta koskevissa teksteissä lukee, että kilpirauhashormonia T3 syntyy 20 % kilpirauhasessa ja 80 % muualla kehossa dejodinaation aikaansaamassa muunnossa, sekä että kilpirauhanen tuottaa hormoneja T4 ja T3 suhteessa 14:1.
Potilaat ovat etsineet lähteitä tähän, mutta vain yksi ainoa lähde on löytynyt (yleensä tieteessä sanotaan, ettei yksi lähde riitä): Pilon tutkimus vuodelta 1990.
Pilon ryhmä tutki kokonaista 14 kilpirauhasterveen ihmisen kilpirauhashormonituotantoa. Otanta oli niin pieni, että oikeasti arvoista ei voida laskea hajontaa. Jostain syystä osallistujille annettiin 56 kertaa suurempi annos jodia, kuin mitä nykyisin pidetään Yhdysvalloissa saannin ylärajana vuorokaudessa. Tämä on saattanut sotkea mittaustuloksia kautta linjan.
Koehenkilöiden arvot vaihtelivat laajalla skaalalla, eikä kilpirauhasen tuottama T4/T3 ollut tasan 14:1. Itse asiassa se vaihteli välillä 6,4 – 71,5. Muunnon osuus kokonais-T3-tuotannosta vaihteli 58 ja 93,5 prosentin välillä.
Kokosin tämän kirjoituksen kannalta mielenkiintoisimmat arvot taulukkoon. Siitä näkee, että vaihtelu yksilöiden välillä oli erittäin suurta. Koehenkilöt olivat siis terveitä, eikä tätä tutkimusta tehty lääkeannosten selvittämiseksi. Tästä ei mitenkään voi päätellä, että kilpirauhanen tuottaa tasan 5 ug T3:a vuorokaudessa, tai että tämä olisi suurin tarvittava lääkeannos korvaushoidossa. Mikäli kilpirauhanen on tuhoutunut eikä muunto toimi, ollaan lähempänä 20 – 40 ug vuorokausiannosta + imeytymishäviöt.

Koejoukosta siis mitattiin alkuparametrit verikokein ja mittauksin. Sitten heille annettiin radiojodilla merkittyä T4- ja T3-hormonia ja seurattiin niiden poistumista kehosta.
Taulukossa on merkitty paksulla mustalla suurimmat arvot ja punaisella pienimmät.
ETA:n suositus yhdistelmähoidosta vuodelta 2012 alkaa näin:
”Introduction
Hypothyroidism is a condition characterized by the clinical and biochemical manifestations of thyroid hormone deficiency in the target tissues of thyroid hormone. The most common cause of hypothyroidism is deficient production of thyroid hormones by the thyroid gland. Thyroxine (T4) is produced exclusively by the thyroid gland; its daily production rate is about 100 g at an average body surface area of 1.79 m 2 (56.2 g/day/m 2). Daily production rate of triiodothyronine (T3) for a body surface area of 1.79 m 2 is about 29 g (16 g/day/m 2): 20% ( 6 g, or 3.3 g/day/m 2 ) is secreted by the thyroid gland, and 80% ( 23 g, or 12.7 g/day/m 2) is generated in extrathyroidal tissues by 5 -deiodination of T4 [1]”
1 Pilo A, Iervasi G, Vitek F, Ferdeghini M, Cazzuola F, Bianchi R: Thyroidal and peripheral
production of 3,5,3 -triiodothyronine in humans by multicompartmental analysis. Am J
Physiol 1990;258:E715–E726.
Pilon tutkimusraportti on siis ETA:n suosituksen ensimmäinen kirjallisuusviite!
Pilon tutkimukseen ja ennen kaikkea sen soveltamiseen liittyvää kritiikkiä löytyy lisää englanniksi täältä: https://thyroidpatients.ca/?s=pilo&x=0&y=0&orderby=relevance&order=DESC
Kaikki kilpirauhasen vajaatoimintaan käytettävät lääkkeet ovat yhtä hyviä
Yhdysvaltain sotilaslääketieteen endokrinologit (Walter Reed Military Hospital) ovat pitkään tutkineet etenkin eläinperäisiä kilpirauhaslääkkeitä verrattuna tyroksiiniin.
Ensimmäinen tutkimusraportti julkaistiin vuonna 2013:
Desiccated thyroid extract compared with levothyroxine in the treatment of hypothyroidism: a randomized, double-blind, crossover study
Thanh D Hoang 1, Cara H Olsen, Vinh Q Mai, Patrick W Clyde, Mohamed K M Shakir
- PMID: 23539727
- DOI: 10.1210/jc.2012-4107
Siinä pieni potilasjoukko sai joko tyroksiinia tai eläinperäistä, kuivattua sian kilpirauhasuutetta. Kumpikin lääke oli yhtä hyvä ja vailla sivuvaikutuksia. 48,6 % potilaista piti eläinperäistä lääkettä parempana, kun taas 18,6 % piti tyroksiinia parempana.
Pian aloitettiin jatkotutkimus, jonka piti alun perin valmistua vuonna 2018. Siihen saatiin mukaan professori Antonio Bianco. Tutkimus valmistui lopulta tämän vuoden keväällä. Se esiteltiin endokrinologien keväisessä tapaamisessa maaliskuussa 2021. https://www.endocrine.org/news-and-advocacy/news-room/featured-science-from-endo-2021/combination-thyroid-hormone-therapies-treat-hypothyroidism-as-well-as-levothyroxine
Combination thyroid hormone therapies treat hypothyroidism as well as levothyroxine
Washington, DC March 20, 2021
Treatment should be individualized for common thyroid condition, researchers say
Haastattelussa endokrinologi Hoang kertoo, että kilpirauhasen vajaatoiminnan hoito pitää räätälöidä erikseen kullekin potilaalle. Käytettävissä ovat niin eläinperäinen valmiste, kuin synteettinen yhdistelmähoito ja tyroksiinimonoterapia. Ne ovat kaikki yhtä hyviä, ja vailla haittavaikutuksia.
Hoangin mukaan yhdistelmä on yhtä validi hoito kilpirauhasen vajaatoimintaan, kuin tyroksiini. Endokrinologi T. Hoang puolusti vahvasti myös eläinperäistä yhdistelmälääkettä. Uusi tutkimus julkaistaan lähiaikoina. Siinä 75 satunnaisesti valittua kilpirauhaspotilasta (blogistin huomio: parempi olisi ollut valikoida niitä, jotka eivät voi hyvin tyroksiinilla) oli jokainen 3 kk tyroksiinilla, 3 kk synteettisellä yhdistelmällä ja 3 kk eläinperäisellä kilpirauhaslääkkeellä. Koehenkilöistä vain 23 % piti tyroksiinia parhaana. 45 % piti eläinperäistä ja 32 % synteettistä yhdistelmää parhaana.
Itse tutkimusraportti julkaistiin 3. toukokuuta 2021. Se on huomattavan lyhyt. Ehkäpä yksityiskohdat julkaistaan myöhemmin?
J Endocr Soc. 2021 May 3; 5(Suppl 1): A827–A828.Published online 2021 May 3. doi: 10.1210/jendso/bvab048.1687 PMCID: PMC8090032
Desiccated Thyroid Extract Versus Synthetic LT4/T3 Combination Versus LT4 Monotherapy in the Treatment of Primary Hypothyroidism With Special Attention to the Thr92AlaD2 Polymorphism. With Special Attention to the Gene Polymorphism
Hashimoto- eli autoimmuunitulehduspotilaat pitivät muita useammin eläinperäistä lääkettä parempana kuin tyroksiinia tai synteettistä yhdistelmää. (Suomessa autoimmuunitulehdus on yleisin kilpirauhasen vajaatoiminnan aiheuttaja.) Tämä tutkimus oli satunnaistettu kaksoissokkotutkimus.
LISÄYS:
11 päivää tämän artikkelin julkaisun jälkeen julkaistiin laajempi tutkimusraportti:
https://academic.oup.com/jcem/advance-article/doi/10.1210/clinem/dgab478/6311304
Thanh Duc Hoang, DO,1Daniel I Brooks, PhD,1Antonio Bianco, MD,2Elizabeth A Mcaninch, MD,3Tatiana L Fonseca, PhD,2Vinh Q Mai, DO,5 and Mohamed K M Shakir, MD5
Endokrinologit, potilaat ja poliitikot kapinoivat

”Pienehköllä potilasryhmällä, noin 5-10 prosentilla, esiintyy jäännösoireita, vaikka verikokeet olisivat kunnossa. Tietenkin tämä voi joskus johtua muista vaivoista, mutta kilpirauhasen vajaatoiminta on somaattinen (ruumiillinen) sairaus, ei toiminnallinen häiriö”, sanoo endokrinologi Birte Nygaard.
Endokrinologit, potilaat ja poliitikot kapinoivat: ”Kilpirauhasen vajaatoimintaa ei pidä käsitellä toiminnallisena häiriönä”
Kirjoittaja Maiken Skeem 26.06.2020
Kilpirauhasyhdistyksessä ja endokrinologien piirissä ollaan suuttuneita potilaiden puolesta: Kilpirauhassairaus on ruumiillinen sairaus, ei toiminnallinen häiriö, ja sen vuoksi sitä ei pidä hoitaa alueellisissa toiminnallisten häiriöiden keskuksissa, potilaiden haitaksi. Kilpirauhasyhdistys on äskettäin, yhdessä yhden asiassa mukana olevan endokrinologin kanssa esittänyt Kansankäräjien terveysvaliokunnalle : Vastustajat suuttuivat asioiden kulun vuoksi.
Vuonna 2018 varattiin 17 miljoonaa Tanskan kruunua kilpirauhasen vajaatoiminnan parempaan hoitoon. Vuonna 2020 tähän tuli kuitenkin muutos: 5 miljoonaa kruunua tästä summasta tulisi käyttää toiminnallisten häiriöiden hoitoon. Päätettiin siis yhdistää kilpirauhasen vajaatoiminnan jäännösoireet, hoidosta huolimatta, toiminnallisiin häiriöihin.
Kilpirauhasen vajaatoiminta on hyvin määritelty fyysinen sairaus
Ennen kaikkea potilasyhdistys, ja endokrinologit potilaiden puolesta, ovat suuttuneita siitä, että kilpirauhaspotilaat nyt niputetaan yhteen toiminnallisista häiriöistä kärsivien potilaiden kanssa, siis potilaiden, joilla on oireita ilman todettua sairautta.
Birte Nygaard on Herlevin sairaalan endokrinologi (ja tunnettu kilpirauhastutkija), ja hän huomauttaa, että kilpirauhasen vajaatoiminta eli hypotyreoosi on hyvin määritelty fyysinen sairaus, joka diagnosoidaan verikokeiden avulla. Se ei ole toiminnallinen häiriö.
”Tanskassa on noin 150.000 kilpirauhasen vajaatoimintapotilasta. Ylivoimainen enemmistö heistä on hyvin hoidettuja ja voi hyvin. Mutta pienempi ryhmä potilaita, noin 5-10 % kokee jäännösoireita, vaikka verikokeiden tulokset näyttävät hyvältä. Tietenkin tämä voi johtua muista vaivoista, mutta hypotyreoosi on ruumiillinen, somaattinen sairaus, ei toiminnallinen häiriö. Mikäli esittäisin potilailleni, että he voivat tulla hoitoon toiminnallisten häiriöiden keskukseen, he pyytäisivät minua ottamaan heidät todesta.
Vaarana ongelmallinen selvitys
”On epäilemättä olemassa sellaisia vajaatoimintapotilaita, joilla mahdollisesti on myös toiminnallinen häiriö. Mutta on myös todennäköisesti ihmisiä, joilta on katkennut jalka, ja joilla on toiminnallinen häiriö. Kilpirauhasyhdistyksessä olemme loukkaantuneita potilaiden puolesta, ja pelkäämme myös, että siirtämällä tämän pienen potilasryhmän hoito maan toiminnallisten häiriöiden hoitokeskuksiin saadaan aikaan ongelmallinen potilaiden selvittely ja mahdollisesti jätetään taustalla olevat sairaudet huomioimatta. Oireet eivät katoa muulla kuin oikealla lääkehoidolla, eikä siis voida parantaa esim. B12-vitamiinin puutosta sairauden hallintastrategioilla. Tulisi yksinkertaisesti liian helpoksi lokeroida meidät toiminnallisten häiriöiden lokeroon.”
Lukuisista kyselyistä huolimatta kukaan ei ole pystynyt kertomaan potilasyhdistykselle tai endokrinologeille, kuka teki tämän päätöksen, että varat (5 miljoonaa kruunua) pitäisi laittaa toiminnallisten häiriöiden keskuksiin.
Sundhedspolitisk Tidsskrift-lehti on tässä asiassa lähettänyt Terveyshallitukselle kyselyn, jotta asiaan saataisiin selvyys. Sundhedsstyrelsen tukee päätöstä liittää kilpirauhasen vajaatoimintapotilaiden pieni ryhmä toiminnallisten häiriöiden keskusten alaisuuteen. Saimme seuraavan vastauksen ylilääkäri ja suunnitteluosaston osastopäällikkö Lotte Klitfodilta:
”Terveyshallituksessa myönnämme tietenkin, että kilpirauhasen vajaatoiminta on somaattinen sairaus, ja että sairaus kuuluu endokrinologian erikoisalaan. Valitettavasti on olemassa potilasryhmä, joka ei lääketieteellisesti oikeasta hoidosta huolimatta endokrinologien alaisuudessa voi hyvin, ja joille ei voida laboratoriokokein osoittaa muuta syytä heidän jäännösoireilleen. Näiltä potilailta puuttuu nyt hyvä mahdollisuus hoitoon. Jälkioireista kärsiville potilaille voi, diagnoosista riippumatta, olla hyötyä avusta sairauden hallinnassa. Potilaat voivat näin saavuttaa paremman toiminnallisen tason ja paremman elämänlaadun. Toiminnallisten häiriöiden keskuksilla on paljon kokemusta sairauden hallinnan auttamisesta, ja olemme siksi sitä mieltä, että keskukset voivat yhteistyössä endokrinologian osastojen kanssa olla hyödyksi sellaisille kilpirauhaspotilaille, jotka kärsivät vajaatoiminnan jäännösoireista. Toivomme siksi, että varat auttaisivat suurempaa potilasjoukkoa saamaan hyvää hoitoa.”
Lääkintöhallituksen vaatimukset eivät vaikuta kohtuullisilta
Tällä yritetään ilmeisesti torpata eläinperäisten lääkkeiden tutkiminen.)
”Sen lisäksi, että puhutaan kohtuuttoman lyhyestä hakemusajasta, endokrinologian osastot eivät yksinään voi hakea rahoitusta, vaan niiden on tehtävä yhteistyötä toiminnallisten häiriöiden hoitokeskusten kanssa. Näille kerrottiin rahoituksesta viikkoa ennen rahoituksen haun julkaisemista, kun taas endokrinologian osastoille ei ole kerrottu asiasta etukäteen. Tämä näyttää harkitulta esteeltä hakemusprosessille, jossa hakuaika on kovin lyhyt. Olisi voitu esimerkiksi varoittaa Tanskan kilpirauhaslääkäreiden liittoa samalla, kun asiasta kerrottiin toiminnallisten häiriöiden keskuksilla. Nyt ne ovat saaneet etumatkaa, kun taas endokrinologeille viritettiin ansa.”
Terveysvaliokunta kuunteli tarkkaan
”He olivat oikeasti järkyttyneitä siitä, ettei meille ollut kerrottu enempää asiassa, ja he puistivat päätään sille, että selässämme lukee nyt ”toiminnallinen häiriö”. Erityisesti Liselott Blixt (DF), joka on perusteellisesti perehtynyt asiaan, oli loukkaantunut asioiden kulusta.”
Sundhedspolitisk Tidsskrift-lehti tapasi Liselott Blixtin heti terveysvaliokunnan kokouksen jälkeen. Hän oli selvästi ärtynyt kilpirauhaspotilaiden tilanteesta:
”Suutuin todella siitä, että asia on edennyt näin hitaasti. Se osoittaa vain sen, että kun hallitus vaihtuu, niin aiemmin tehdyt sopimukset eivät pidä. Minulla oli selvä sopimus aiemman terveysministerin, Ellen Trane Nørbyn (V) kanssa siitä, että 17 miljoonaa kruunua piti varata kilpirauhasen vajaatoimintapotilaille, mutta ymmärrän nyt tämän päivän terveysvaliokunnan kokouksen jälkeen, ettei näin ole tapahtunut uuden hallituksen astuttua virkaansa. Näyttää lähinnä siltä, että Terveyshallituksessa on haluttu kampittaa kilpirauhaspotilaita. Tämä ei ole hyväksyttävää, ja toivomme nyt voivamme vaikuttaa istuvaan hallitukseen, jotta kampitus päättyisi.”
Näin meillä kiusataan potilasta
Potilas oli tyytyväisenä käyttänyt kilpirauhasen vajaatoimintaan yhdistelmäterapiaa T4 + T3 eri muodoissaan 10 vuoden ajan. Hän oli päätynyt siihen, koska tyroksiini oli vähitellen lakannut toimimasta, ja hänelle tuli täydellinen aivosumu ja aloitekyvyttömyys. Hän ei osannut enää laskea 2 + 2, vaikka hänellä oli takanaan korkeamman matematiikan opintoja yliopistotasolla.
Muutamaa vuotta aiemmin yksityinen sisätautilääkäri oli lähettänyt hänet kilpirauhasen ultraäänikuvaan, josta ilmeni että autoimmuunitulehdus oli surkastuttanut kilpirauhasen lähes olemattomaksi. Tällainen kilpirauhanen ei tuota enää juuri mitään hormoneja.
Viime vuonna potilas joutui sairaalaan muun syyn takia. Häneltä otettiin pois omat lääkkeet, ja tilalle määrättiin tyroksiinia, vaikka potilas kertoi ettei elämänlaatu sillä ole hyvä. Potilasta kohdeltiin kuin tämä ei tietäisi mistään mitään, ja hänelle kerrottiin aivan suoraan, että hänen lääkkeensä ovat laittomia, ja hänet yritettiin saada tuomitsemaan ne lääkärit, jotka olivat niitä hänelle määränneet. Kovasti yritettiin myös saada selville, kuka nyt viimeksi on määrännyt näitä ”kiellettyjä lääkkeitä”, jotka ovat lääkeluettelossa ja Fimean sallimia erityislupalääkkeitä (T3).
Väitettiin kivenkovaa, että lääkemääräys, joka ei näy Kannassa, on laiton. Myöhemmin on käynyt ilmi, että aivan kotimainen reseptijärjestelmä ei näy Kannassa eikä julkiseen terveydenhuoltoon, saati ulkomailla toimivan lääkärin kirjoittamat EU-reseptit… ovatko nämä siis oikeasti laittomia?
Sen jälkeen konsultoitiin sairaalan johtavaa endokrinologia, kertomatta siitä etukäteen. Ei kerrottu edes jälkikäteen lääkärin nimeä, vaan se selvisi myöhemmin Kannasta.
OYSin pääendokrinologi nosti vähitellen tyroksiinin määrää, koska T3-V, joka siis yllättäen mitattiin, oli alle viitteiden. Lopulta se nousi viitteen alarajalle, jolloin kaikki muut, paitsi potilas, olivat tyytyväisiä. Potilas kärsi taas aivosumusta, ajattelun hitaudesta, ja muista kilpirauhasen vajaatoiminnan oireista. Pian viitealueen alarajaa nostettiin, jolloin se ”erinomainen” T3-V-arvo oli selvästi alle viitteiden.
Potilas tiesi kuitenkin Hoermannin tutkimusryhmän kehittämästä instrumentista, jolla voidaan todeta muunnon riittävyys tai riittämättömyys. Spina-Thyr osoitti, että tämän potilaan muunto ei riitä.

Mutta tätähän lääkärit eivät uskoneet, sillä he uskoivat kaikkitietävään sairaalan endokrinologiin. Tämä taas ei potilaiden käsityksen mukaan oikeasti osaa hoitaa kilpirauhaspotilaita. Seuraavaksi potilas yritti päästä endokrinologin puheille, mutta häntä ei huolittu vastaanotolle. Potilaan arvothan olivat loistavat!
Ilmeisesti ketään täkäläisessä sairaanhoidossa ei kiinnosta, mitä uusia tutkimustuloksia ja mittausmenetelmiä on viimeisen kymmenen vuoden aikana julkaistu.
Suomalaisia endokrinologeja ei ole näkynyt lainkaan ulkomaisissa kilpirauhasta käsittelevissä kongresseissa puhujina.
Onko kilpirauhasen vajaatoiminta toiminnallinen vaiva?
Tanskan viranomaiset julkaisivat keväällä tiedotteen, jonka mukaan sairaalat voivat hakea rahaa perustaakseen kilpirauhaspotilaille sairautta käsitteleviä kouluja toiminnallisten vaivojen laitosten alaisuuteen. Erään tanskalaisen potilasjärjestön puheenjohtaja, Anett Kromann, sai tänään julki mielipidekirjoituksen terveyspoliittisessa aikakauslehdessä. https://sundhedspolitisktidsskrift.dk/meninger/kommentarer/3459-endnu-en-gang-traeffes-der-besynderlige-beslutninger-pa-stofskifteomradet.html
Jälleen kerran tehtiin omituinen päätös kilpirauhassairauksien alueella
Anett Kromann 8. kesäkuuta 2020
Keskustelu

Anett Kromann, Foreningen StofskifteSupport
MIELIPIDE: Minkä takia alueelliset toiminnallisten häiriöiden keskukset liitetään kilpirauhassairauksien rahoitukseen? Se vastaisi sitä, että diabeteskoulut olisivat toiminnallisten häiriöiden keskusten alaisuudessa, sillä diabetes ja kilpirauhassairaudet ovat molemmat endokrinologisia sairauksia, kirjoittaa Anett Kromann, Foreningen StofskifteSupport, tässä mielipidekirjoituksessa.
Lokakuussa 2018 varattiin 5 miljoonaa Tanskan kruunua kilpirauhassairauksien lääketieteelliseen tutkimukseen. Tämä syntyi seurauksena poliittisesta sopimuksesta hallituksen ja Tanskan kansanpuolueen välillä. Rahaa annettiin terveydenhoidon korkealle priorisoiduille toimenpiteille, joista kilpirauhassairaudet oli yksi osa.
Tiedämme, että rahaa on annettu alan lääketieteellisiin tutkimuksiin, mutta yhdistystä StofskifteSupport ei ole informoitu siitä, mihin asti tutkimuksissa on päästy, tai onko niitä käynnissä.
5 miljoonaa on osa 17 miljoonan kruunun kokonaisuudesta, joka myönnettiin kilpirauhassairauksien tehostettuun hoitoon.
Osana aloitteista näkyy:
”Perustetaan potilaskouluja lisäämään potilaiden ymmärrystä heidän sairaudestaan, elämästä kroonisen sairauden kanssa ja heidän elämänsä aikana kokemista mahdollisista oireista tai vaivoista.”
Asetettu toiminnallisten häiriöiden alaisuuteen
28. toukokuuta 2020 kerrotaan seuraavaa Terveyshallituksen kotisivulla:
5 miljoonaa kruunua kilpirauhasen vajaatoiminnan oireista kärsiville potilaille. ”Tästä päivästä lähtien lääketieteelliset osastot voivat hakea varoja poikkitieteellisiin hoitoihin sellaisille potilaille, joilla on jäljellä kilpirauhasen vajaatoiminnan oireita. Heille jotka eivät saa apua lääkkeistä.” Ja siteerataan osastopäällikkö Lotte Klitfodia: ”Alueellisissa toiminnallisten häiriöiden keskuksissa on asiantuntemusta auttaa tätä potilasryhmää, ja toivomme että varatut rahat voisivat auttaa kehittämään mallin, joka voidaan ottaa käyttöön koko maassa.”
Tämä rahoitus, jota voivat hakea vain sairaaloiden endokrinologit, koskee siis toiminnallisia häiriöitä, ryhmää johon kilpirauhassairaudet eivät kuulu. Moni potilas kokee oireita, vaikka laboratoriokokeiden tulokset olisivatkin normaalit. Oireet eivät katoa muuten kuin oikealla lääkityksellä.
Kilpirauhasen vajaatoiminnasta kärsivät saavat yleensä T4-lääkettä, joka on esihormonia. Tämän esihormonin pitää kuitenkin elimistössä muuntua aktiiviseksi T3-hormoniksi. Mikäli näin ei tapahdukaan eri syistä, voi seurauksena ilmetä monia elämää häiritseviä oireita. Kysymys kuuluukin, onko perinteinen lääke tarpeeksi hyvä.
Kyseessä on yleensä autoimmuunisairaus, joka todetaan verikokeilla
Autoimmuuni kilpirauhastulehdus (Hashimoton kilpirauhastulehdus) joka on kilpirauhasen vajaatoiminnan yleisin syy, todetaan verikokeella. Autoimmuunisairaus voi aiheuttaa lukuisia oireita, ennenkuin varsinainen kilpirauhasen vajaatoiminta on syntynyt. Terveydenhoitojärjestelmä ei huomioi autoimmuunisairautta, vaan odottaa selvän vajaatoiminnan ilmenemistä. Tämän rajapinnan tarkempi tutkimus olisi hyödyllistä.
Kilpirauhaspotilaina oletimme, että asiaa tutkittaisiin lääketieteellisesti. Emme suinkaan odottaneet että meidät pistettäisiin toiminnallisten vaivojen osaksi, jolla ei ole mitään tekemistä sairauden fyysisten ja psyykkisten oireiden kanssa (jotka usein johtuvat väärästä lääkehoidosta).
Århusin yliopistosairaalan mukaan toiminnallisen häiriön määritelmä on: ”Toiminnallinen häiriö on yhteinen nimitys ryhmälle sairauksia, joissa potilas kokee fyysisiä oireita tai on huolissaan fyysisistä oireista, jotka vaikeuttavat jokapäiväistä toimintaa. Näitä oireita ei voida liittää toiseen tunnettuun ja hyvin määriteltyyn diagnoosiin.”
Tästä käy selvästi ilmi, etteivät kilpirauhaspotilaat kuulu tähän ryhmään. Asia koskee maanlaajuisesti 152.350 ihmistä, jotka eivät saa oireisiinsa apua. Luku on vuodelta 2017, ja uskomme että heitä on nyt paljon enemmän.
Monissa Terveyshallinnon kokouksissa, joihin yhdistys StofskifteSupport osallistui, vallitsi laaja yksimielisyys siitä, että kilpirauhassairaudet ovat fyysisiä sairauksia, jotka todetaan verikokeilla.
Kuuluvatko diabeteskoulut toiminnallisten häiriöiden aluekeskusten alaisuuteen?
Ylläolevilla perusteilla on hyvin vaikeaa ymmärtää, että kilpirauhassairaudet kytketään toiminnallisten häiriöiden aluekeskuksiin. Toiminta vastaa sitä, että diabeteskin liitettäisiin niihin. Diabetes ja kilpirauhassairaudet kuuluvat endokrinologian alaisuuteen.
Olemme erittäin iloisia siitä, että kilpirauhassairaiden hoitoon ja diagnosointiin kiinnitetään enemmän huomiota. Koemme kuitenkin ongelmaksi, että sairaus, jota ei tunnetusti ole tutkittu läheskään tarpeeksi, tällä tavalla asetetaan aivan eri sairausnimikkeen alaisuuteen. Olemme erittäin huolissamme siitä, että tästä muodostuu este sen selvittämiselle, mitä voidaan lääkkeellisesti tehdä sairauden hoidon parantamiseksi. Tämä koskee erityisesti Hashimoton autoimmuunitulehduksesta kärsiviä, sillä Hashimoton autoimmuunitulehdus on yleisin syy kilpirauhasen vajaatoimintaan.
Tyroksiini kuin tyroksiini?
Merck valmistaa T4-valmistetta nimellä Levothyrox, joka tunnetaan myös nimellä Euthyrox. Se oli muutama vuosi sitten ainoa Ranskassa myytävä tyroksiinivalmiste. Sitten tapahtui kummia: lääkkeen koostumusta muutettiin, ja potilaat alkoivat valittaa ettei lääke enää auta heitä. Asiasta ei ilmoitettu etukäteen, ja vasta kaivamisen jälkeen muutos tuli ilmi. Ranskan viranomaiset olivat vaatineet koostumuksen muuttamista.
Tämän jälkeen Ranskan markkinoille on tullut muitakin tyroksiinivalmisteita.
Näytti siltä, että muutettu valmiste tulisi myyntiin myös Ruotsissa. Tämä sai ruotsalaiset potilaat hermostumaan. Ruotsin myydyin tyroksiinivalmiste on Takedan Levaxin, jolla on viime vuosina ollut toimituskatkoksia. Valmiste on nyt myynnissä Ruotsissa.
Merck teetti tutkimuksen uudella ja vanhalla koostumuksella. Koehenkilöille annettiin kerralla 600 ug T4, vanhaa valmistetta ja uutta. T4-pitoisuus mitattiin sitten 72 tunnin kuluttua lääkkeen otosta.
Artikkeliin on tullut useita kommentteja, joista yksi on aivan tuore Hoermannin tutkijaryhmältä.
https://doi.org/10.1007/s40262-020-00887-x
Ryhmä piirsi kuvan alkuperäisistä mittaustuloksista:

Jokainen pystyviiva edustaa yhtä potilasta, sininen piste pitoisuutta vanhalla koostumuksella ja punainen uudella. Joillakin potilailla pitoisuudet olivat suunnilleen samat, toisilla hyvin erilaiset. Vaihtelu on myös suurta potilaiden välillä.
Pitäisi selkeämmin ottaa huomioon jokaisen potilaan yksilölliset ominaisuudet, kuten lääkkeen imeytyminen.
Merck tuomittiin toimittamaan vanhan koostumuksen lääkettä sellaisille ranskalaisille potilaille, joita uusi koostumus ei auta.
Artikkelia selostetaan myös täällä: https://www.tandfonline.com/doi/abs/10.1080/03007995.2016.1246434
Tänään tanskalainen potilasyhdistys kirjoittaa, että vanhaa koostumusta ei saa enää ollenkaan 4.5.2020 jälkeen. https://stofskiftesupport.dk/medier/euthyrox-ny-formulering/ Ruotsi ja Norja haluavat siirtyä uuteen versioon heti pääsiäisen jälkeen.
Tanskalaisten luettelo rinnakkaistuontilääkkeistä ja niiden eränumeroista:
https://stofskiftesupport.dk/medicin-lavt-og-hoejt-stofskifte/parallelimport-af-euthyrox-eltroxin/
Siitä on nyt viisi vuotta
Toista sataa kilpirauhasaktivistia kokoontui perustamaan uutta yhdistystä helmikuussa 2015. Valittiin toimikunta valmistelemaan perustamista. Tasan viisi vuotta sitten yhdistys näki päivänvalon nyt niin ajankohtaisessa Skype-kokouksessa. Onnittelut Kilpolle!


